|
|

|
|
Química del carboni
| Fórmules químiques | Cadena
carbonada | Classes d'àtoms de carboni | Isòmers
| Funció química i grup funcional | Nomenclatura
|
|
|
|
Química del carboni
|
Els éssers vius estan formats principalment per C carboni, H
hidrogen, O oxigen i N nitrogen. En menor mesura, contenen
també S sofre i P fòsfor, a més
d'alguns halògens i metalls. Per això els
compostos de carboni es coneixen amb el nom de compostos
orgànics (o dels éssers vius). Però,
compte, també hi ha molts altres compostos de carboni que no
formen part dels éssers vius.
La part de la Química que estudia els compostos del carboni
és la Química Orgànica o
Química del Carboni, ja que aquest element és
comú a tots els compostos orgànics.
La Química Orgànica és la
Química del Carboni. Per compostos orgànics
entenem els compostos del carboni, excepte els òxids CO i
CO2 i els carbonats que s'estudien com a compostos
inorgànics des de sempre. La Química
Orgànica no és només la
química dels compostos dels éssers vius, inclou
també els compostos derivats del petroli i del
carbó, i els preparats sintèticament al
laboratori.
El nombre de compostos orgànics coneguts (alguns milions
actualment) és molt superior al de compostos
inorgànics, tot i que en la seva composició hi
entren tan pocs elements. La raó d'aquest fet s'ha de buscar
en la capacitat que presenta el carboni per combinar-se
fàcilment amb ell mateix i amb altres elements
mitjançant enllacos covalents.
La configuració electrònica del carboni
és:
[C]=1s22s2 2px1 2py1 2pz0
A causa de la poca diferència d'energia entre els orbitals
2s i els 2p, és fàcil promoure un
electró 2s a un orbital 2p, de manera que s'obté
la configuració:
[C]=1s22s1 2px1 2py1 2pz1
que permet la formació de quatre enllaços
covalents per compartició d'electrons, amb ell mateix o amb
altres elements, i així es guanya amb escreix l'energia
invertida abans per a promoure l'electró a un orbital
superior.
A causa del gran nombre de compostos orgànics i la immensa
varietat de les seves mides i estructures, cal una mínima
sistematització en la seva nomenclatura. La IUPAC
(Unió Internacional de Química Pura i Aplicada)
va dissenyar unes normes que es basen fonamentalment en la
utilització de prefixos que indiquen el nombre
d'àtoms de carboni de les cadenes carbonades i sufixos per
informar sobre la presència dels diversos grups funcionals,
que es converteixen en prefixos específics quan no actuen
com a grup principal en els compostos polifuncionals.
Veurem més a poc a poc les normes bàsiques de
formulació de les funcions orgàniques
més representatives.
|

|
|
Fórmules químiques
|
La fórmula química és la forma escrita
d'una molècula. Ha de proporcionar, com a mínim,
dues informacions importants: quins elements formen el compost i en
quina proporció s'hi troben.
La fórmula pot ser:
És la fórmula més senzilla possible.
Indica quins elements formen la molècula i en quina
proporció es troben. És la fórmula que
s'obté a partir de la composició centesimal d'un
compost. Per exemple, si tenim un hidrocarbur (format per H i C) podem
cremar-lo en presència d'oxigen i, a partir del CO2 i H2O
que es formen, determinar la quantitat de C i H que conté.
Aleshores cal calcular els mols de C i H i, després, dividir
aquestes dues quantitats pel valor més petit per determinar
la proporció dels àtoms en el compost,
és a dir, la seva fórmula empírica.
Exemple: CH, compost format per carboni i
hidrogen, en la proporció: 1 a 1.
Indica el nombre total d'àtoms de cada element a la
molècula. Per determinar la fórmula molecular a
partir de l'empírica, cal conèixer la massa
molecular del compost. A partir de les propietats
col·ligatives, com la pressió
osmòtica, el descens crioscòpic o l'augment
ebulloscòpic, podem calcular la massa molecular. Amb la
fórmula empírica i la massa molecular, es troba
la fórmula molecular amb una simple proporció.
Hi ha tres maneres diferents d'escriure una fórmula
molecular:
| Condensada |
Expressa el tipus i nombre d'àtoms de la
molècula però no informa dels enllaços
que presenta. |
Exemple: C6H6 compost format per sis àtoms de
carboni i sis àtoms d'hidrogen.
|
| Semidesenvolupada |
Només s'hi representen els enllaços carboni-carboni. |
Exemple: HC ≡ CH presenta un enllaç triple carboni-carboni. |
| Desenvolupada o Estructural |
S'hi representen tots els enllaços de la molècula. |
Exemple: H - C ≡ C - H En la majoria dels casos n'hi ha prou amb la
fórmula semidesenvolupada. |
Abreugen l'escriptura i indiquen la distribució dels
àtoms en el pla o a l'espai.
| Planes |
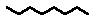
en comptes de CH3 - CH2
- CH2
- CH2
- CH2
- CH2
- CH2
- CH3 |
| Tridimensionals |
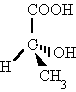
Les falques i línies discontínues volen ajudar a
donar perspectiva a la molècula. COOH i H estan en el pla.
OH està darrere del pla. CH3
està davant del pla.
|
|

|
|
Cadena carbonada
|
|
És la seqüència d'àtoms de
carboni, units entre ells, que formen l'esquelet de la
molècula orgànica.
Hi ha diferents tipus de cadena, segons la forma que tingui:
Pot ser:
|
Lineal |
No porta cap tipus de substitució. Els àtoms de
carboni es poden escriure en línia recta. També
es poden escriure retorçades per ocupar menys espai.
És important saber veure que encara que estigui
torçada és una cadena lineal.
|
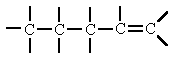 |
| Ramificada |
D'algun dels carbonis de la cadena lineal, en surt una altra o unes
altres cadenes secundàries o branques.
|
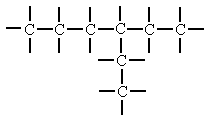 |
N'hi ha de diversos tipus:
| Homocíclica |
Els àtoms del cicle són àtoms de
carboni.
|
| Heterocíclica |
Algun àtom de carboni del cicle ha estat substituït
per un altre àtom, per exemple N, S, O, etc.
|
| Monocíclica |
Només hi ha un cicle. |
| Policíclica |
Hi ha diversos cicles units. |
|

|
|
Classes d'àtoms de carboni
|
|
| Primari |
Un carboni és primari si està unit
només a un àtom de carboni.
|
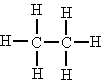
Els dos àtoms de carboni són primaris |
| Secundari |
Si està unit a dos àtoms de carboni. |
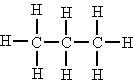
L'àtom de carboni central és secundari. |
| Terciari |
Si està unit a tres àtoms de carboni. |
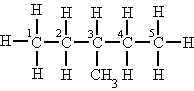
L'àtom de carboni (3) és terciari. |
| Quaternari |
Si està unit a quatre àtoms de carboni. |
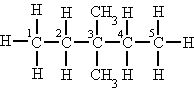
L'àtom de carboni (3) és quaternari. |
|

|
|
Isòmers
|
|
S'anomenen isòmers dos o més compostos diferents
que tenen la mateixa fórmula molecular, però
diferent fórmula estructural, i diferents propietats
físiques o químiques.
|

|
|
Funció química i grup funcional
|
|
S'anomena funció química cada grup de compostos
amb propietats i comportaments químics
característics.
Cada funció es caracteritza per tenir un agregat, d'un o
més àtoms, que s'anomena grup funcional.
Les funciones químiques que formularem, amb els seus grups
funcionals, es troben a la taula següent.
|

|
|
Nomenclatura
|
|
És el conjunt de regles que permeten assignar,
unívocament, un nom a cada compost químic.
És la que s'ajusta a un sistema prefixat.
S'han de seguir els convenis establerts per la IUPAC (Unió
Internacional de Química Pura i Aplicada).
En aquesta web: IUPAC Nomenclature of Organic Chemistry
es recullen les recomanacions de la IUPAC de 1979 i de 1993.
Arrelada en el lenguaje químic convencional, tot i que no
segueix unes normes prefixades.
Molts d'aquests noms tradicionals estan acceptats per la IUPAC.
|

|
|
