|
Los cuatro primeros tienen un nombre sistemático que consiste
en los prefijos met-,
et-, prop-,
y but-
seguidos del sufijo "-ano". Los demás se nombran mediante los prefijos griegos que indican
el número de átomos de carbono y la terminación "-ano".
| Fórmula |
Nombre |
Radical |
Nombre |
 |
Metano |
 |
Metil-(o) |
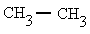 |
Etano |
 |
Etil-(o) |
 |
Propano |
 |
Propil-(o) |
 |
Butano |
 |
Butil-(o) |
 |
Pentano |
 |
Pentil-(o) |
 |
Hexano |
 |
Hexil-(o) |
 |
Heptano |
 |
Heptil-(o) |
 |
Octano |
 |
Octil-(o) |
Otros nombres de la serie de los alcanos son los siguientes:
| Nº de C |
Nombre |
Nº de C |
Nombre |
| 9 |
nonano |
30 |
triacontano |
| 10 |
decano |
31 |
hentriacontano |
| 11 |
undecano |
32 |
dotriacontano |
| 12 |
dodecano |
40 |
tetracontano |
| 13 |
tridecano |
41 |
hentetracontano |
| 14 |
tetradecano |
50 |
pentacontano |
| 15 |
pentadecano |
60 |
hexacontano |
| 16 |
hexadecano |
70 |
heptacontano |
| 17 |
heptadecano |
80 |
octacontano |
| 18 |
octadecano |
90 |
nonacontano |
| 19 |
nonadecano |
100 |
hectano |
| 20 |
icosano |
200 |
dihectano |
| 21 |
henicosano |
300 |
trihectano |
| 22 |
docosano |
579 |
nonaheptacontapentahectano |
Se llama radical alquilo a las agrupaciones
de átomos procedentes de la eliminación de un átomo de H en un alcano, por lo
que contiene un electrón de valencia disponible para formar un enlace covalente.
Se nombran cambiando la terminación -ano por -ilo, o -il cuando forme parte de
un hidrocarburo.
Cuando aparecen ramificaciones (cadenas
laterales) hay que
seguir una serie de normas para su correcta nomenclatura.
-
Se elige la cadena más larga. Si hay dos o más cadenas con igual número de
carbonos se escoge la que tenga mayor número de ramificaciones.
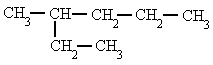
|
| 3-metilhexano |
-
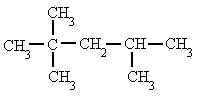
Se
numeran los átomos de carbono de la cadena principal comenzando por el extremo que
tenga más cerca alguna ramificación, buscando que la posible serie de números "localizadores"
sea siempre la menor posible.
|
| 2,2,4-trimetilpentano, y no 2,4,4-trimetilpentano |
-
Las
cadenas
laterales
se
nombran antes que la cadena principal, precedidas de su correspondiente número localizador
y con la terminación "-il" para indicar que son radicales.
-
Si un mismo átomo de carbono tiene dos radicales se
pone el número localizador delante de cada radical y se ordenan por
orden
alfabético.
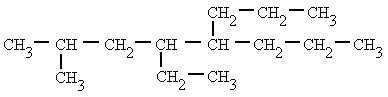 |
| 4-etil-2-metil-5-propiloctano |
-
Si un mismo radical se repite en varios carbonos, se
separan los números localizadores de cada radical por comas y se antepone al radical
el prefijo "di-",
"tri-", "tetra-", etc.
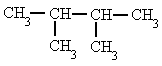
|
| 2,3-dimetilbutano |
-
Si hay dos o más radicales diferentes en distintos
carbonos, se
nombran por orden
alfabético
anteponiendo su número localizador a cada radical. en el orden alfabético no se tienen en cuenta los prefijos: di-, tri-,
tetra- etc. así como sec-, terc-, y otros como cis-, trans-, o-, m-, y p-;
pero cuidado si se tiene en cuenta iso-.
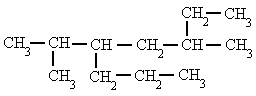
|
| 5-isopropil-3-metiloctano |
-
Si las cadenas laterales son complejas, se nombran de forma independiente
y se colocan, encerradas dentro de un paréntesis como los demás radicales por orden
alfabético.
En estos casos se ordenan por la primera letra del radical. Por ejemplo, en el
(1,2-dimetilpropil) si tendremos en cuenta la "d" para el orden
alfabético,
por ser un radical complejo. En las cadenas laterales el localizador que lleva
el número 1 es el carbono que está unido a la cadena principal.
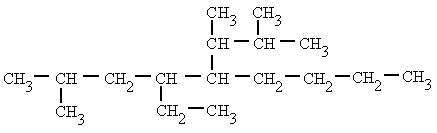 |
| 5-(1,2-dimetilpropil)-4-etil-2-metilnonano |
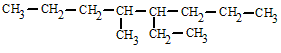 |
| 4-etil-5-metiloctano |
|
|
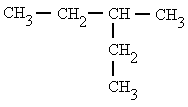 |
3-metilpentano |
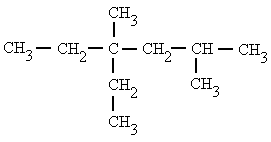 |
4-etil-2,4-dimetilhexano |
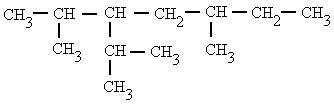 |
3-isopropil-2,5-dimetilheptano |
La nomenclatura de la IUPAC admite los
nombres tradicionales de algunos radicales substituidos, lo que facilita la nomenclatura
en estos casos:
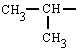 |
isopropilo
(isómero do propilo)
(1-metiletilo)
|
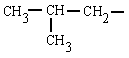 |
isobutilo
(2-metilpropilo)
|
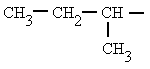 |
secbutilo (butilo
secundario)
(1-metilpropilo) |
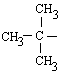 |
tercbutilo (butilo
terciario)
(1,1-dimetiletilo) |
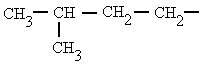 |
isopentilo
(3-metilbutilo)
|
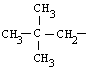 |
neopentilo
(2,2-dimetilpropilo)
|
|
