     |
|
|
|
FENÓMENOS
FÍSICOS E FENÓMENOS QUÍMICOS |
|
Na Natureza atopámonos con moitos procesos de cambio. Estes
procesos podémolos dividir en dous grandes grupos: procesos físicos e procesos
químicos. En que se diferencian?
PROCESOS QUÍMICOS: son procesos de cambio nos que cambia
a natureza das sustancias, unhas sustancias transfórmanse noutras diferentes. Un
exemplo telo na comida, cando preparamos un prato uns ingredientes que compramos
no súper transfórmanse ao cociñalos nunha comida deliciosa que se diferencia
bastante dos ingredientes de partida.
PROCESOS FÍSICOS: son procesos de cambio nos que non
cambia a natureza das sustancias, as sustancias seguen sendo as mesmas despois
do cambio. Por exemplo cambiar un corpo de sitio, quentalo, facelo cambiar de
estado, non supón que se converta nunha sustancia diferente.
EXERCICIOS
PARA PRACTICAR

|
|
MAGNITUDES FÍSICAS |
|
A que chamamos
magnitudes en física?
MAGNITUDE: é calquera propiedade dun corpo que sexa medible, é dicir, que se
poida cuantificar ou expresar con números.
Diferenciaremos entre magnitudes fundamentais e magnitudes derivadas, estas
defínense a partir das fundamentais, que son escollidas por convenio entre os
científicos.
Que é medir unha
magnitude física?
MEDIR é comparar unha cantidade dunha magnitude con outra cantidade da mesma
magnitude que se toma como patrón (ou referencia) e que se denomina UNIDADE.
Fíxaste como mide a distancia a unha barreira o árbitro nun partido? Se a
barreira parécelle que está moi preto do xogador que saca a falta mide con pasos
a distancia á que debe estar a barreira. Compara a distancia á que está a
barreira con outra distancia, o seu paso. Cando non temos unha unidade de medida
mellor un paso sácanos do apuro, é unha medida aproximada, pero sempre será
mellor unha medida aproximada que ningunha medida. Recorda o verbo importante é
comparar, medir é comparar, xa sabes que.
Como elixir unha unidade?
Cando se
elixe unha unidade pénsase nunha serie de requisitos que é conveniente que
cumpra, como :

|
|
MEDIDAS E ERROS |
|
Como debemos expresar o
resultado dunha medida?
Debemos ser
conscientes que nunca poderemos realizar unha medida que nos dea un valor exacto
do que medimos. Estamos condicionados polos aparellos de medida que utilizamos.
Por exemplo, se medimos cunha cinta métrica que está graduada en centímetros
nunca poderemos conseguir unha precisión de milímetros na medida.
Xa que logo,
cando realizamos unha medida cometemos erros. Non porque queiramos, senón porque
é así o proceso de medida.
Se
realizamos unha única medida cometemos unha imprecisión que equivale á división
máis pequena do aparello de medida. Fíxate sempre en cal é a división máis
pequena dos aparellos de medida que utilices.
Por exemplo,
medimos un folio cunha regra que aprecia milímetros. Obtemos un resultado de
29,7 cm. Como debemos indicar esta medida? Esta lonxitude deberiámola indicar da
seguinte forma: L = 39,7 ± 0,1 cm
Erro absoluto
0,1 cm é a
imprecisión que cometemos cando realizamos medidas cunha regra graduada en
milímetros. Esta cantidade é o erro absoluto que cometemos cando facemos
esta medida.
Se facemos unha única
medida o erro absoluto é equivalente á imprecisión do aparellos de medida, ou á
súa división máis pequena.
Como nunca
coñeceremos o valor exacto dunha medida podemos achegarnos a ese valor repetindo
varias veces a medida, logo calculamos a media aritmética, e ese será o valor
que tomamos como valor exacto ou real.
Para unha serie de medidas, o erro absoluto é a
diferenza entre o valor obtido nunha medida e o valor exacto, calculado coa
media aritmética.
O erro absoluto será como mínimo o valor da
división máis pequena do aparello de medida.
Erro relativo
As medidas poden ser moi diferentes, en xeral
medidas grandes terán erros absolutos grandes e medidas pequenas terán erros
absolutos pequenos. Si queremos saber o boa ou mala que é unha medida debemos
calcular o erro relativo que relaciona o erro absoluto dunha medida co valor
exacto da medida, e adóitase dar en tanto por cen. Canto menor sexa o erro
relativo mellor, de máis calidade, será a medida.
O erro relativo é o cociente en porcentaxe do
erro absoluto dunha medida e o valor exacto da medida.
EXERCICIOS
PARA PRACTICAR

|
|
|
|
SISTEMA INTERNACIONAL
DE UNIDADES (S.I.) |
|
Ata finais do século
XIX, cada país utilizaba para medir una mesma magnitude unha unidade diferente.
Hoxe en día, a maioría dos países acepta o SISTEMA INTERNACIONAL DE UNIDADES
(S.I.)
As unidades fundamentais
do Sistema Internacional:
|
Magnitudes básicas do Sistema Internacional de Unidades |
|
MAGNITUDE |
UNIDADE |
SÍMBOLO |
| Lonxitude |
metro |
m |
| Masa |
quilogramo |
kg |
| Tempo |
segundo |
s |
| Intensidade de corrente eléctrica |
amperio |
A |
| Temperatura termodinámica |
grao Kelvin |
K |
| Cantidade de substancia |
mol |
mol |
| Intensidade luminosa |
candela |
cd |
|
DEFINICIÓNS |
| |
DEFINICIÓN
PREVIA |
DEFINICIÓN
DENDE 2019 |
| metro |
O metro é a distancia percorrida pola luz no baleiro
en
1/299.792.458 segundos. |
O metro, símbolo m, é a unidade SI de
lonxitude. Defínese ao fixar o valor numérico da velocidade da luz no
baleiro, c, en 299 792 458, cando se expresa na unidade m·s−1,
onde o segundo defínese en función da frecuencia do Cesio ΔνCs.
c = 299 792 458 m·s−1 |
| quilogramo |
Masa do quilogramo patrón internacional, que se
conserva en Sèvre, perto de Paris. |
O quilogramo, símbolo kg, é a unidade SI
de masa. Defínese ao fixar o valor numérico da constante de Planck, h, en
6,626 070 15·10−34, cando se expresa na unidade J· s, igual
a kg·m2·s−1, onde o metro e o segundo defínense
en función de c e ΔνCs. h = 6,626 070 15·10−34
J·s |
| segundo |
Duración de 9.192.631.770 períodos
da radiación do átomo de cesio-133 na transición entre dous niveis da estructura
hiperfina do seu estado fundamental. |
O segundo, símbolo s, é a unidade SI de
tempo. Defínese ao fixar o valor numérico da frecuencia da transición
hiperfina do estado fundamental non perturbado do átomo de cesio-133, ΔνCs,
en 9 192 631 770, cando se expresa na unidade Hz, igual a s−1.
ΔνCs = 9 192 631 770 s−1 |
| amperio |
Intensidade dunha corrente eléctrica constante que, cando flúe entre dous condutores paralelos de lonxitude indefinida e de sección transversal circular infinitamente pequena situados a unha distancia recíproca de 1 metro e colocados no baleiro, fai que un condutor exerza sobre o outro unha forza de
2.10-7 newtones por
cada metro. |
O amperio, símbolo A, é a unidade SI de
corrente eléctrica. Defínese ao fixar o valor numérico da carga elemental,
e, en 1,602 176 634 ·10−19, cando se expresa na unidade C, igual
a A· s, onde o segundo defínese en función de ΔνCs.
e = 1,602 176 634 ·10−19 C |
| kelvin |
Fracción 1/273,16 da temperatura termodinámica
do punto triple da auga. |
O kelvin, símbolo K, é a unidade SI de
temperatura termodinámica. Defínese ao fixar o valor numérico da constante
de Boltzmann, k, en 1,380 649 ·10−23, cando se expresa na unidade
J· K−1, igual a kg·m2·s−2·K−1,
onde o quilogramo, o metro e o segundo defínense en función de h, c e ΔνCs.
k = 1,380 649 ·10−23 J·K−1 |
| mol |
Cantidade de substancia dun sistema que
contén
tantas entidades elementais como átomos hai en 0,012 kg de carbono-12.
Débese especificar o tipo das entidades elementais, xa sexan átomos,
moléculas, ions, electróns, ou outras. |
O mol, símbolo mol, é a unidade SI de
cantidade de substancia. Un mol contén exactamente 6,022 140 76 ·1023
entidades elementais. Esta cifra é o valor numérico fixo da constante de
Avogadro, NA, cando se expresa na unidade mol−1, e
denomínase número de Avogadro.
A cantidade de substancia, símbolo n, dun sistema, é unha medida do número
de entidades elementais especificadas. Unha entidade elemental pode ser un
átomo, unha molécula, un ión, un electrón, calquera outra partícula ou grupo
especificado de partículas.
NA = 6,022 140 76 ·1023 entidades elementales. |
| candea |
Intensidade luminosa, nunha dirección dada, dunha fonte que emite unha radiación monocromática de frecuencia 540 × 1012 hercios e cuxa intensidade energética nesa dirección é 1/683 vatios por estereorradián. |
A candea, símbolo cd, é a unidade SI de
intensidade luminosa nunha dirección dada. Defínese ao fixar o valor
numérico da eficacia luminosa da radiación monocromática de frecuencia
540·1012 Hz, Kcd, en 683, cando se expresa na unidade
lm·W−1, igual a cd·sr·W−1, ou a cd· sr·kg−1·m−2·s3,
onde o quilogramo, o metro e o segundo defínense en función de h, c e ΔνCs.
Kcd = 683 lm·W−1 |
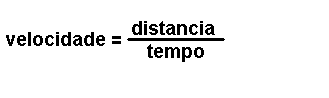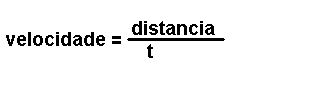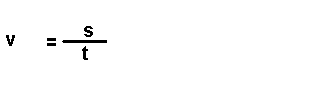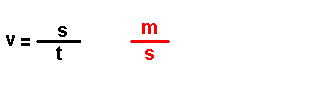
Magnitudes
derivadas.
Son magnitudes que se definen a partir das magnitudes fundamentais. Por
exemplo:
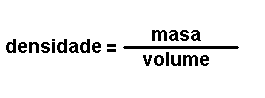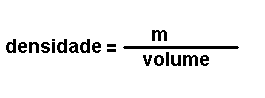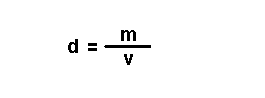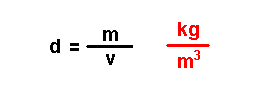
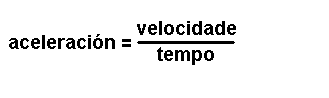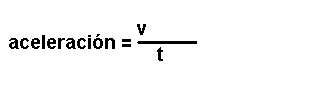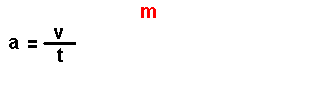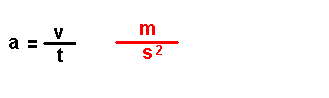
Múltiplos
e submúltiplos:
| Prefixo |
Símbolo |
Factor multiplicador |
| Tera- |
T |
1012 u |
| Xiga- |
G |
109 u |
| Mega- |
M |
106 u |
| quilo- |
k |
103 u |
| hecto- |
h |
102 u |
| deca- |
da |
10 u |
| unidade |
u |
1 u |
| deci- |
d |
10-1 u |
| centi- |
c |
10-2 u |
| mili- |
m |
10-3 u |
| micro- |
μ |
10-6 u |
| nano- |
n |
10-9 u |
| pico- |
p |
10-12 u |
O factor multiplicador é o número polo que tes que multiplicar a medida para
transformala na unidade.
Por exemplo, 2 Mm = 2·106 m ou
5 nm = 5·10-9 m

|
|
TRANSFORMACIÓN DE
UNIDADES |
|
As unidades transfórmanse con facilidade a
través dos factores de conversión. Consiste en multiplicar unha medida
polo cociente que nos dá a equivalencia entre a unidade que queremos substituír
e a nova unidade. Este cociente ten valor unidade, xa que o numerador é
equivalente ao denominador. A unidade que poñemos no denominador é a que
queremos eliminar, e no numerador vai a nova unidade. Cando escribas a
equivalencia entre as unidades dálle valor unidade á maior delas. Por exemplo: é
máis fácil entender 1 km = 1000 m que 1 m = 0,001 km aínda que
sexan as dúas igualdades válidas.
A equivalencia entre (km) e (m) é: 1 km = 103 m

EXERCICIOS
PARA PRACTICAR
A equivalencia entre
(km) e (m) é: 1 km = 103 m. E
a
equivalencia entre (h) e (s) é: 1 h
= 3600 s.

A equivalencia entre
(km) e (m) é: 1 km = 103 m. E
a
equivalencia entre (h) e (s) é: 1 h
= 3600 s.

EXERCICIOS
PARA PRACTICAR
É importante
tamén saber pasar de complexo de h:min:s a horas, e viceversa, xa que na
vida diaria manexámonos en horas, minutos e segundos. Por exemplo, cando
abriches esta páxina eran as:
. Que facer nestes casos?
Pasar de
complexo a incomplexo: Cantas horas son 2h:25min:30s?
a) Pasa os minutos a horas, e os segundos a horas e suma: 2h:25min:30s = 2h
25min · 1h/60min 30s · 1h/3600s = 2,425h
b) Ou tamén, aproveitar a tecla (º ' '') de grados, minutos e segundos da
calculadora, que tamén segue o sistema sexaxesimal:
2h:25min:30s = 2 (º ' '') 25 (º ' '') 30 (º ' '') = 2,425h
Pasar de incomplexo a complexo: Cantas h:min:s son 1,755h?
a) Pasa os decimales de horas a minutos, e os decimales de minutos a
segundos:
1,755h = 1h 0,755h · 60min/1h = 1h 45,3 min = 1h 45min 0,3 min · 60s/1min
=1h 45min 18s
b) Ou tamén, aproveitar a tecla (º ' '') de grados, minutos e segundos da
calculadora, que tamén segue o sistema sexaxesimal:
1,755h = 1,755 (º ' '') (=) (º ' '') = 1º 45º 18 = 1h 45min 18s
EXERCICIOS
PARA PRACTICAR

|
|
O MÉTODO CIENTÍFICO |
|
É o método que seguen os científicos para
realizar o seu traballo, que é descubrir esas leis que se agachan no mundo que
nos rodea e permítennos entendelo mellor. Con elas poderemos predecir situacións
novas e buscar aplicacións tecnolóxicas que nos fagan a vida máis agradable.
Este método baséase nunha serie de etapas que
haberá que seguir de forma consecutiva.
1º) Presentación dun
problema a investigar.
Os nenos pequenos unha das cousas que primeiro
aprenden a dicir é por que?. Os científicos tamén. Só que estes o din durante
toda a vida. E non son fáciles de convencer, parten da experiencia da realidade
que lles proporciona a observación.
OBSERVACIÓN: Tratar de extraer a máxima
información, a poder ser cuantitativa, do fenómeno observado.
-
Teremos que MEDIR, para transformar as
nosas observacións en datos cuantitativos.
-
Empregaremos APARELLOS DE MEDIDA que
deberán estar adecuadamente calibrados e manipulados.
-
RECOLLEITA DE DATOS: Recolleremos toda
a información complementaria que podamos, e aproveitaremos outras
investigacións previas ou similares.
2º) Dar unha explicación
do problema.
Os interrogantes que xorden no apartado anterior
hai que explicalos mediante diferentes hipóteses. É importante non desechar a
priori ningunha das hipóteses.
FORMULACIÓN DE HIPÓTESES: Unha hipótese é
unha suposición que explica determinado fenómeno e que pode ser comprobada por
vía experimental. As hipóteses poden ser válidas ou non válidas, serán válidas
cando se poidan comprobar por medio de experimentos cuantitativos. As hipóteses
válidas poden ser verdadeiras ou falsas, serán verdadeiras cando o resultado do
experimento confirma a hipótese, si o resultado do experimento contradi a
hipótese será falsa.
3º) Comprobar
experimentalmente a veracidad das hipóteses.
EXPERIMENTACIÓN: Primeiro illaremos as
variables que inflúen no problema. Logo observaremos que ocorre ao manter
constantes todas as variables menos dúas. Como se comporta unha cando varía a
outra? Elaboraremos gráficas para indagar a relación matemática entre as
variables. Con esta información verase se se verifica a hipótese ou non.
4º) Emisión de
conclusións.
Redactar o informe da investigación, coas
hipóteses que se aceptan como verdadeiras. Debe recoller o proceso desde a
presentación do problema ata a emisión de conclusións.
Nada mellor para entender o Método Científico que
practicalo. A seguinte práctica pódese facer en casa con materiais sinxelos.
Podes chegar a descubrir a lei do péndulo e fabricar un reloxo moi simple.
Atrévete.
  

|
|
CAMBIADOR
DE UNIDADES |
|
Utiliza como separador de decimais o punto:

|
  
|
|
