   
|
|
|
|
REACCIONES
QUÍMICAS
|
Piensa en una reacción química. Seguramente pensaste en
la combustión, es normal, es una de las reacciones que más nos marcaron
como especie desde siempre.
Pero ¿qué ocurre en una combustión? Un combustible, sea madera,
alcohol, gasolina, o papel se transforma en otras sustancias como cenizas
y humo y se desprende gran cantidad de calor en forma de llama.
Una reacción química es un proceso en el que unas sustancias, que
llamamos reactivos, se transforman en otras, que llamamos productos.
¿Pero qué ocurre realmente durante una reacción química? Al
observar una reacción química, por ejemplo una combustión, una
fermentación o una oxidación, podemos pensar que se crean unas
sustancias y desaparecen otras, como si fuera magia. ¿Es esto lo que
sucede? ¿Es magia? Pues resulta que no, aunque a veces lo parezca. Cuando
realizamos una reacción en un recipiente cerrado comprobamos que la masa
no varía. Por lo tanto la materia que tenemos al principio es la misma
que tenemos al final. La materia está hecha de átomos, como ya vimos.
Entonces lo que se conserva en una reacción química son los
átomos. Los átomos no se crean ni se destruyen durante una
reacción química. ¿Por cierto, donde se formaron los átomos
entonces? Observa este vídeo:
Por algo decía Carl Sagan que somos polvo de estrellas. Así que ya
sabes, no defraudes a la estrella que llevas dentro. Cuando tiene lugar
una reacción química las moléculas de los reactivos chocan hasta
conseguir romper los enlaces entre los átomos. Esos átomos se pueden
ahora unir de otra forma dando lugar a los productos. Es decir, en una
reacción química se rompen enlaces en los reactivos y se forman los
enlaces que dan lugar a los productos. Para que esto ocurra los choques
que se producen entre las moléculas de los reactivos deben tener cierta
energía y cierta orientación para que sean eficaces, para que puedan dar
lugar a los productos. Por ejemplo para esta reacción:
Se pueden producir dos tipos de choques: eficaces que den lugar a
productos, o ineficaces que no dan lugar a productos.
Podemos representar en un diagrama las energías de los reactivos y productos de una reacción.
Hay procesos donde se desprende energía, por ejemplo las reacciones de
combustión, en ellas los productos tienen menos energía que los
reactivos, durante la reacción esta diferencia de energía se libera,
decimos que la reacción es exotérmica y que la ΔE<0. Hay otros
procesos donde se absorbe energía, por ejemplo la disolución de algunas
sales, en ellas los productos tienen más energía que los reactivos,
durante la reacción esta diferencia de energía se absorbe, decimos que
la reacción es endotérmica y que ΔE>0. Pero el paso de
reactivos a productos no es directo como aparece en este esquema. En 1888 el químico sueco Svante Arrhenius propone que las moléculas
deben tener un mínimo de energía para poder reaccionar. Cuando dos
moléculas chocan su energía cinética debe tener un valor mínimo para
que se rompan y formen los productos. Esta energía mínima que
necesitan las moléculas para reaccionar se llama energía de
activación, Ea, y tiene un valor diferente para
cada reacción. Una energía de activación más alta implica mayor
dificultad para que las moléculas de los reactivos pasen a productos, lo
que disminuye la velocidad de reacción. La temperatura también juega un
papel importante, a mayor temperatura de los reactivos mayor número de
moléculas pueden alcanzar la energía de activación que les permite pasar
a productos.
|
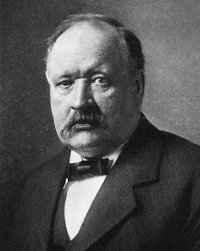
|
|
Svante Arrhenius (1859-1927) |
Cuando
los reactivos chocan para dar los productos lo hacen a través de estados
intermedios con más energía que los reactivos. En este estado intermedio
o complejo activado se están rompiendo unos enlaces y formando otros
nuevos. La energía que separa
los reactivos de ese estado intermedio, o complejo activado, se llama energía
de activación.
Cuanto más alta sea la energía de activación menos moléculas
tendrán energía para pasar a productos y la velocidad de reacción será
más lenta. Por velocidad de reacción entendemos la cantidad de
reactivos que se consumen por unidad de tiempo, o la cantidad de productos
que se forman por unidad de tiempo. ¿Por qué cuando iniciamos las
reacciones de combustión necesitamos acercar al combustible una llama o
una chispa? pues para poder superar esta energía de activación en el
instante inicial, cuando la reacción se inicia la energía que se libera
ya es suficiente para mantener la energía de activación que las moléculas
precisan para poder reaccionar. EJERCICIOS
PARA PRACTICAR

|
|
FACTORES QUE INFLUYEN SOBRE
LA VELOCIDAD DE REACCIÓN
|
|
Hay una serie de factores que afectan a las reacciones químicas. Su
conocimiento nos puede ayudar a entender y modificar la velocidad de una
reacción. 1. Concentración de los reactivos.
Al aumentar las concentraciones
de los reactivos aumenta la velocidad de la
reacción. Lo podemos justificar a partir de la teoría de
colisiones. Al aumentar la concentración de un gas se hacen más
frecuentes los choques, y por tanto el número de choques eficaces, lo
que dará lugar a un aumento de la velocidad. 2. Naturaleza
química, estado físico y grado de división de los reactivos.
Es
fácil entender que diferentes reactivos den velocidades de reacción diferentes.
La naturaleza de los diferentes enlaces que se tienen que romper y
formar condiciona la velocidad de la reacción. Las reacciones
en fase gas o en disolución también suelen ser más rápidas que con
reactivos sólidos, o con reactivos en fases diferentes (reacciones
heterogéneas). En fase gas y en disolución son más fáciles los
choques entre moléculas lo que favorece la velocidad, esta es la razón
que en la industria y en el laboratorio se trabaje preferentemente en
fase gas o en disolución. El mayor grado de división de las partículas
que reaccionan también favorecen un aumento de velocidad de reacción,
se aumenta la superficie de contacto entre reactivos y esto favorece un
aumento de velocidad. 3. Aumento de la temperatura.
El
aumento de la temperatura con muy pocas excepciones produce un aumento
de la velocidad de reacción. Al aumentar la temperatura aumenta la
agitación térmica de las moléculas, aumenta su velocidad, y por tanto
su energía cinética, habrá más moléculas que alcancen la energía
de activación lo que produce un aumento de la velocidad.
Esta es la razón de que todos tengamos
frigoríficos en nuestras casas. A bajas temperaturas los procesos de
descomposición de los alimentos y el metabolismo de las bacterias se
ralentizan, haciendo que los alimentos se conserven durante más tiempo
con plenas garantías sanitarias. 4. Presencia de catalizadores.
Los catalizadores son sustancias químicas. Sus características son:
- En pequeñas cantidades aumentan notablemente la velocidad de
reacción, o en el caso de los inhibidores la ralentizan.
- No participan en la reacción química, por tanto no se consumen
durante la misma, recuperándose al final de esta.
El papel de los catalizadores es favorecer el contacto entre los
reactivos, haciendo que disminuya la energía de activación,
consiguiendo así que la reacción sea más rápida. Prácticamente no
hay procesos industriales en donde no participen los catalizadores. La
industria no sólo necesita obtener productos, necesita obtenerlos con
rapidez y a bajo coste, para lo cual es fundamental la utilización de
catalizadores. Los inhibidores también tienen un papel fundamental en
la industria alimentaria en la que ralentizan las reacciones que
deterioran los alimentos.
EJERCICIOS
PARA PRACTICAR

|
|
ECUACIONES
QUÍMICAS
|
| Tenemos que distinguir bien dos cosas. Por un lado lo que
es la reacción química, que es algo físico que ocurre, y por
otro la ecuación química, que es la representación con fórmulas
de la reacción química.
Por ejemplo, encendemos la cocina de butano, ¿qué reacción tiene
lugar? Pues la combustión del butano que proporciona calor para cocinar y
unos gases que no vemos pero que también se desprenden, de la misma forma
que se consume también otro gas que es el oxígeno.
Para representar mejor esta reacción usaremos una ecuación química:
En la ecuación química representamos la reacción química colocando
a la izquierda de la flecha los reactivos, las sustancias que hacemos
reaccionar, y a la derecha de la flecha los productos, las sustancias que
se obtienen de la reacción.

|
|
AJUSTE
DE ECUACIONES QUÍMICAS
|
| Las ecuaciones químicas son las representaciones de las reacciones químicas o transformaciones químicas, y constan de dos miembros; en el primero se indican las fórmulas de las sustancias iniciales, que se denominan reactivos, y en el segundo las de las sustancias que se obtienen, y se denominan productos. Los miembros se separan por una flecha (-->) para señalar el sentido de una reacción o dos flechas con los sentidos contrarios (<-->) para indicar que la reacción está en equilibrio, es decir, que coexisten sustancias reaccionantes y productos.
Como por ejemplo, en la combustión del metano se produce dióxido de carbono y agua. La ecuación que representa esta reacción es:
CH4 + O2 → CO2 + H2O
Para que la ecuación cumpla con la ley de conservación de la masa es imprescindible que esté ajustada o igualada, es decir, que haya el mismo número de átomos en cada miembro de la ecuación. Se utilizan entonces unos números, los coeficientes estequiométricos, que se colocan delante de las fórmulas e indican el número relativo de moléculas.
CH4 + 2 O2 → CO2 + 2
H2O
En determinados casos hace falta especificar el estado físico: sólido (s), líquido (l), gas (g), o disolución acuosa (aq), en que se encuentran las sustancias en las condiciones de la reacción.
CH4(g) + 2 O2(g) → CO2(g) + 2
H2O(l)
En las ecuaciones ajustadas podemos hacer dos lecturas: una microscópica, por ejemplo, una molécula de metano con dos moléculas de oxígeno produce una molécula de dióxido de carbono y dos de agua, esto es poco práctico aunque didáctico porque nunca vamos a trabajar con tan poca materia, más interesante es la lectura
macroscópica, por ejemplo, un mol de metano con dos moles de oxígeno produce un mol de dióxido de carbono y dos moles de agua. Esto será particularmente útil cuando realicemos cálculos estequiométricos.
Si en la reacción intervienen ións, hay que igualar, además, eléctricamente, para que cumpla la ley de conservación de la carga. Como por ejemplo:
Zn + Ag+ → Zn2+ + Ag
Zn(s) + 2 Ag+(aq) →
Zn2+(aq) + 2 Ag(s)
Método para ajustar ecuaciones químicas: el método más sencillo es el de
tanteo, se contarán los átomos de cada elemento en reactivos y productos y se colocarán los coeficientes delante de las fórmulas para que los elementos queden igualados, debes dejar para ajustar al final los elementos que aparezcan en varias fórmulas en reactivos o productos. Ten en cuenta que al ajustar un elemento puedes desajustar otro, por tanto repasa todo al final.
Un ejemplo: Combustión del propano
C3H8 + O2 → CO2 +
H2O
El oxígeno participa en más de un compuesto en productos, lo dejaremos para el final. Empezamos por el C, 3 carbonos en reactivos y 1 carbono en productos, necesitamos 3 moléculas de
CO2 para ajustarlo.
C3H8 + O2 → 3
CO2 + H2O
Seguimos con el H, 8 hidrógenos en reactivos y 2 hidrógenos en productos, necesitamos 4 moléculas de
H2O para ajustarlo.
C3H8 + O2 → 3
CO2 + 4 H2O
Sólo nos faltan los O, 2 oxígenos en reactivos y 3·2+4·1=10 en productos, necesitamos 5 moléculas de
O2 en reactivos para ajustarlo.
C3H8 + 5
O2 → 3 CO2 + 4
H2O
Ya está la ecuación ajustada, el coeficiente del propano es 1 aunque no se
escriba. Recuerda que lo que no puedes modificar son los coeficientes de cada elemento dentro de las moléculas, ya que cambiarías las sustancias, sólo podemos modificar el número de moléculas.
EJERCICIOS
PARA PRACTICAR

|
|
TIPOS DE REACCIONES
|
|
Podemos clasificar las reacciones químicas en seis grandes grupos:
1.- Reacciones de síntesis:
2 H2 (g) + O2 (g) → 2 H2O
(l)
A partir de los elementos obtenemos un compuesto.
2.- Reacciones de descomposición:
CaCO3 (s) → CaO (s) + CO2
(g)
Una única sustancia se descompone en varias.
3.- Reacciones de desplazamiento:
Cu (s) + 2 AgNO3 (aq) → Cu(NO3)2
(aq) + 2 Ag (s)
Un elemento más activo reemplaza a otro menos activo en un compuesto.
4.- Reacciones de doble desplazamiento:
Na2CO3 (aq) + CaCl2
(aq)
→ CaCO3 (s) + 2 NaCl (aq)
Se produce un intercambio entre dos compuestos, en el ejemplo se ve
favorecido por la precipitación de carbonato de calcio.
5.- Reacciones de neutralización, o ácido-base:
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O
(l)
Según el modelo de Brönsted-Lowry se denominan también reacciones e
transferencia protónica.
6.- Reacciones Redox:
Zn (s) + 2 HCl (aq) → ZnCl2 (aq) + H2 (g)
También denominadas reacciones de transferencia de electrones.

|
|
CÁLCULOS
ESTEQUIOMÉTRICOS
|
| Las ecuaciones químicas ajustadas nos van a permitir
realizar cálculos cuantitativos en las reacciones químicas. Si conocemos
la cantidad de reactivo de que disponemos podemos calcular la cantidad de
producto teórica que podemos obtener. Debido a que podemos hacer una
interpretación macroscópica de las ecuaciones químicas podemos conocer
las proporciones en moles que se establecen entre los reactivos y
productos. Conociendo los moles, no sólo conocemos el número de
partículas, también las masa y en el caso de gases los volúmenes que
reaccionan.
No viene mal recordar lo que aprendimos el curso pasado de: MOL,
MASA
MOLAR, VOLUMEN
MOLAR.
Para la reacción anterior, la combustión del propano, podemos encontrar
unas posibles masa que pueden reaccionar y obtenerse, transformando los
moles en masa:
C3H8 + 5 O2 → 3 CO2 + 4
H2O
1 mol + 5 mol → 3 mol + 4 mol
44g + 5·32g → 3·44g + 4·18g
La ecuación ajustada nos proporciona la siguiente
información: 1 mol de C3H8 con 5 moles de O2
nos permiten obtener 3 moles de CO2 y 4 moles de H2O.
Si calculamos las masas molares podemos decir: 44g de C3H8
con 5·32g de O2 nos permiten obtener 3·44g de CO2
y 4·18g de H2O.
Estas relaciones en masa nos permiten hacer cálculos
químicos, que llamaremos cálculos estequiométricos.
Ejemplo: La descomposición térmica del carbonato de calcio produce óxido de calcio, o cal viva, y dióxido de carbono. Calcula la masa de cal que podemos obtener a partir de 500g de carbonato de calcio.
Práctica: Determinación del agua de cristalización de una sal
hidratada, como el CuSO4·nH2O
1.- Cálculos con masas.
Son los más sencillos, primero ajustamos la ecuación química,
hacemos una lectura en moles, debajo de los moles ponemos la incógnita y
el dato que nos dan, y por último planteamos una proporción. No olvides
poner las unidades a la respuesta.
EJERCICIOS
PARA PRACTICAR
2.- Cálculos con gases en condiciones normales.
Hacemos lo mismo que en el caso anterior, pero los moles de las
sustancias que sean gases, y estén en condiciones normales, los ponemos
en litros, sabiendo que un mol de cualquier gas ocupa 22,4L en C.N.
EJERCICIOS
PARA PRACTICAR
3.- Cálculos con reactivos en disolución.
Cuando algún dato es un volumen de una disolución de determinada
concentración, debemos calcular los moles de soluto puro o la masa de
soluto puro para realizar los cálculos.
EJERCICIOS
PARA PRACTICAR
4.- Cálculo del reactivo limitante.
Cuando se realiza una reacción se suele utilizar uno de los reactivos
en exceso para garantizar dos cosas, que el reactivo que está en menor
proporción reacciona completamente y que la reacción transcurra a más
velocidad.
Si en un problema nos dan sólo la cantidad de un reactivo debemos
suponer que los demás están en exceso, aunque no lo digan. Pero a veces
nos dan datos de dos reactivos. En este caso debemos calcular el reactivo
limitante que será el que esté en menor proporción y será el que nos
condicione la cantidad máxima de productos que podemos obtener. Si los
coeficientes estequiométricos fueran todos 1, bastaría comparar los
moles de cada reactivos para saber el que está en menor proporción, pero
si los coeficientes son distintos debemos calcular para cada reactivos el
cociente entre el número de moles y el coeficiente que tiene en la
ecuación, el reactivo con este cociente menor será el reactivo limitante
y será el único que usaremos para los cálculos.
EJERCICIOS
PARA PRACTICAR

|
   |
|
