 
|
|
Ada E. Yonath, israelí, recibió en 2009 el Premio Nobel de
Química junto con Venkatraman Ramakrishnan y Thomas A. Steitz por sus
estudios sobre la estructura y función del ribosoma.
Su trabajo se ha centrado en la determinación y el
estudio de la estructura de los ribosomas, macromoléculas responsables
de la síntesis de proteínas y el modo de acción de los antibióticos.
Introdujo una nueva técnica, la criobiocristalografía, en la cual los
cristales de materiales biológicos sensible a la radiación son enfriados
a temperaturas menores de 100 K, lo que facilita su estudio por rayos X.
|
|
ENLACE QUÍMICO
|
|
La razón que hace que los átomos se unan es la razón que mueve todos los cambios de la naturaleza,
los átomos se unen para conseguir más estabilidad. La mayor parte de los átomos son más estables juntos que separados. Intentaremos comprender por qué.
Imagina dos átomos a gran distancia. Si son más estables unidos que separados cuando se acerquen
es porque las fuerzas de atracción serán favorables para la formación del enlace. ¿Cuáles pueden ser estas fuerzas? pues las interacciones de los electrones de un átomo con los protones del otro y viceversa. Pero a medida que se acerquen también estarán sometidos a
fuerzas de repulsión, las establecidas entre los electrones de un átomo y los del otro, o las interacciones entre los núcleos de los dos átomos. Llegará un momento en que las fuerzas atractivas se maximizan y las repulsivas se minimizan, en este momento los núcleos estarán a una distancia que llamaremos
distancia de enlace. Ya no se pueden juntar más pues se repelerían, ni se pueden separar pues se atraerían. Diremos que han quedado enlazados.
Esta distancia de enlace se corresponde con una energía que llamaremos
energía de enlace.
Llamamos enlace químico a la interacción que se da entre los átomos cuando se unen para dar moléculas o redes cristalinas.
Para entender por qué se estabilizan los átomos al formar enlaces es útil fijarse en los únicos elementos de la Tabla que no tienen tendencia a asociarse, son tan estables que no necesitan unirse a otros átomos. Son los
gases nobles. No fue fácil descubrirlos pues existen en pequeñas cantidades en el aire. Hubo que licuar el aire para obtenerlos aislados. Más fantástica es la historia del helio, He, que fue descubierto antes en el Sol que en la Tierra.
¿Por qué son tan estables los gases nobles? Lo único que diferencia a los gases nobles de los demás elementos es que tienen las capas electrónicas completas, con más propiedad, tienen 8 electrones en la capa más externa, los dos electrones s, y los seis electrones p. Tener esta configuración
ns2 np6 debe de conferir gran estabilidad a los átomos. Esta configuración se conoce como
configuración de gas noble.
Todos los demás átomos tienden a conseguir esta configuración de gas noble cuando se combinan con otro átomos. Este comportamiento lo denominamos
Regla del octeto: Los átomos cuando se asocian con otros átomos tienden a ganar, perder o compartir electrones para conseguir configuración de gas noble.
Bien, ya vimos que para conseguir estabilidad los átomos deben conseguir configuración de gas noble, y para conseguir esta configuración deben de ganar, perder o compartir electrones. En función de cómo se comporten los átomos para conseguir configuración de gas noble
encontramos tres enfoques diferentes para el problema del enlace: Enlace iónico, enlace covalente y enlace metálico.
Comprueba las interacciones atractivas y
repulsivas entre átomos utilizando esta simulación de la Universidad de Colorado:
EJERCICIOS
PARA PRACTICAR

|
|
ENLACE IÓNICO
|
|
¿Qué ocurre cuando tenemos dos átomos de muy diferente
electronegatividad? Por ejemplo un metal como el sodio, Na, y un
no metal como el cloro, Cl. Sus configuraciones electrónicas son:
[11Na] = 1s2 2s2
2p6 3s1
[17Cl] = 1s2 2s2
2p6 3s2 3p2 3p2 3p1
Para que estos átomos consigan más estabilidad deben conseguir
configuración de gas noble, la pueden conseguir si el sodio pierde un
electrón, y este electrón lo gana el cloro. Es decir se transfiere un
electrón del sodio al cloro:
[11Na+] = 1s2
2s2 2p6
[17Cl−] = 1s2
2s2 2p6 3s2 3p6
Vemos que se forman dos iones, el metal da
lugar a un ión positivo y el no metal a un ión negativo. Estos iones se
atraen por fuerzas de tipo electrostático de Coulomb, pero no se
tocarán, ya que a pequeñas distancias las fuerzas de repulsión entre las
capas electrónicas de los dos iones los separarían. Por tanto se
mantendrán ligados entre ellos a cierta distancia.
Como no tendremos sólo dos iones, tendremos
muchísimos, cada ión de un signo se rodeará del mayor número de iones de
signo contrario, formándose una red cristalina de iones positivos y
negativos. En el caso del cloruro de sodio, NaCl, esta red será:
El índice de coordinación, o iones de
un signo que rodean a otro de signo contrario, a una distancia mínima,
en esta red es 6. Cada ión Na+ está rodeado de 6 iones Cl−,
y cada ión Cl− está rodeado de 6 iones Na+.
Esta red cristalina se conoce como red cúbica centrada en las caras.
Podemos encontrar redes cristalinas con mayor índice de coordinación,
así la red del CsCl presenta un índice de coordinación 8, cada ión Cs+
se rodea de 8 iones Cl−, y cada ión Cl−
se rodea de 8 iones Cs+. Esta red cristalina se conoce como
red cúbica centrada en el cuerpo.
¿De qué depende que unas redes cristalinas presenten una disposición
de iones diferentes de otras? La diferencia está en las características
de los iones, en sus tamaños relativos y en sus cargas eléctricas, Para
unas características dadas los iones buscarán la estructura más estable.
Cuando los iones no tienen la misma carga, en valor absoluto, no hay
el mismo número de iones que rodean a otro de signo contrario. Por
ejemplo en la fluorita, CaF2, cada ion F−
está rodeado de 4 iones Ca2+, y cada ion Ca2+ está
rodeado por 8 iones F−.
Esta también es una estructura cúbica centrada en las caras, pero de
tipo fluorita.
Podemos estudiar desde el punto de vista energético la formación del
cristal iónico, Supongamos que tenemos los elementos que forman el
cristal y queremos llegar al compuesto iónico. La energía involucrada en
este proceso es la entalpía de formación del cristal cuando el proceso
está realizado a presión constante. Si se forma el cristal esta energía
debe tener un valor negativo. Pero este proceso lo podemos llevar a cabo
a través de otros pasos intermedios, ya que la entalpía es una función
de estado, y sólo depende de los estados inicial y final. El ciclo de
reacciones que nos lleva de estas dos formas diferentes hasta el cristal
se conoce como ciclo de Born-Haber.
Ciclo de Born-Haber: Nos permite calcular la energía de red
aplicando la ley de Hess.
Observamos así que el proceso más favorable en la formación del
cristal iónico es la formación de la red cristalina. La energía
involucrada en conseguir el cristal iónico a partir de los iones en
estado gas es la entalpía reticular o entalpía de red.
Ecuación de Born-Landé: Permite calcular la
entalpía de red a partir de unos parámetros dependientes de los iones
y otros característicos de la red cristalina.
Z+ y Z− = cargas de los iones
e = carga del electrón
NA = número de Avogadro
A = constante de Madelung, depende del tipo de red cristalina
ε0 = permitividad del vacío
r0 = distancia entre los centros de los iones
n = factor de compresibilidad de Born
Si comparamos compuestos que presentan la misma red cristalina la
energía de red será proporcional al siguiente cociente:
En este caso, si tenemos dos compuestos iónicos que cristalizan en la
misma red, evaluando cómo varían las cargas de los iones, o las
distancias entre los mismos, podemos conocer que compuesto presentará
mayor energía de red.
Recuerda que puedes recristalizar sales para obtener cristales
grandes y bien formados, como puedes ver en este vídeo:

|
|
ENLACE
IÓNICO.
PROPIEDADES DE LOS COMPUESTOS IÓNICOS |
|
Los compuestos iónicos presentan unas propiedades resumidas en esta
tabla:
|
PROPIEDADES DE LAS
SUSTANCIAS IÓNICAS |
| Propiedad |
Característica |
¿Por
qué? |
| Estructura |
Redes cristalinas formadas por iones. |
Los iones de distinto
signo se atraen y se rodean del mayor número de iones de signo
contrario, formando una red cristalina iónica. |
| Estado
físico |
Sólidas |
El gran número de iones que forman
la red hace que se presente en estado sólido |
| Puntos de
fusión y ebullición |
Altos |
Los enlaces iónicos son enlaces
fuertes, difíciles de romper. Los puntos de fusión y ebullición
serán más altos en los compuestos iónicos con mayores energías de
red. |
| Dureza |
Son duras pero también frágiles |
Son duras porque los enlaces son
fuertes, pero son frágiles pues al golpearlas las capas de iones se
desplazan entrando en contacto iones del mismos signo que se
repelen. |
| Solubilidad |
Algunas son solubles en agua y disolventes
polares |
Las moléculas polares como el agua
rodean los iones y los separan de la red si las fuerzas de
interacción entre el ión y el agua son mayores que entre el ión y
el resto de la red. Si la energía de red es grande su solubilidad
será muy baja. |
| Conductividad
eléctrica |
Conducen la corriente en disolución
o fundidas |
Para que haya
conductividad debe haber movimiento de cargas, los iones solo se
pueden mover cuando están disueltos o en estado líquido, en las
sales fundidas |
|
Ejemplos |
Cloruro de sodio, NaCl |
 |
|
Sulfato de cobre, CuSO4·5H2O |
 |
|
Calcita, CaCO3 |
 |
|
Otros: Sales: CaSO4, Na2CO3,
NH4NO3. Óxidos: CaO, Fe2O3.
Hidróxidos: NaOH, Ba(OH)2. |
EJERCICIOS
PARA PRACTICAR

|
|
ENLACE COVALENTE. ESTRUCTURAS
DE LEWIS |
|
¿Qué ocurre cuando los elementos que se enlazan son dos no metales?
Los no metales tienden a ganar electrones para conseguir configuración
de gas noble, pero para que un átomo gane electrones debe haber otro que
los pierda, como pasaba en el enlace iónico, pero ahora todos los átomos
tienen necesidad de electrones. En este caso los átomos necesitados de
electrones los tienen que conseguir por otro procedimiento que será
compartiendo electrones. Los átomos se acercarán hasta que sus nubes
electrónicas solapen y puedan compartir cierto número de electrones, con
los que conseguir la configuración de gas noble, que necesitan.
Un primer modelo interesante para entender como se pueden compartir
electrones para conseguir configuración de gas noble es el modelo de las
estructuras de Lewis.
Este modelo, para explicar el enlace covalente, fue propuesto por Gilbert Newton
Lewis en 1916. Según este modelo los átomos se
aproximan hasta solapar sus capas electrónicas, de forma que los
átomos cuando se enlazan comparten pares de electrones. Estos pares de
electrones que se comparten se denominan pares enlazantes. Pero también
podemos tener pares de electrones sin compartir sobre algunos átomos,
que llamaremos pares no enlazantes. En estas estructuras observamos que,
cuando se enlazan, los átomos consiguen tener cuatro pares de
electrones alrededor de los mismos, es decir, consiguen completar el
octeto, consiguen configuración de gas noble.
En el tema
de enlace de 4º de ESO ya vimos como construir estas
estructuras de Lewis para moléculas sencillas.
| Molécula |
Estructura de Lewis |
| H2 |
 |
| F2 |
 |
| Cl2 |
 |
| O2 |
 |
| N2 |
 |
| HF |
 |
| HCl |
 |
| H2O |
 |
| NH3 |
 |
| CH4 |
 |
| HCN |
 |
| CO2 |
 |
En todas observamos que los átomos están rodeados de 4 pares de
electrones, configuración de gas noble, excepto el H que está rodeado
de un par, configuración de gas noble para el hidrógeno.
Para construir estructuras más complejas podemos seguir las normas
siguientes:
1º Elegir el átomo central. Suele ser el menos
electronegativo o el que más electrones necesita para conseguir
estructura de gas noble.
2º Calcular los electrones de valencia necesarios, EN,
para que los átomos cumplan con la regla del octeto. Se contarán 8e−
por cada átomo, con las siguientes excepciones:2e−
para el H, 4e− para el Be, 6e− para el
B. Los elementos a partir del tercer período pueden tener "octetos
expandidos", si son necesarios se sumarán al número de electrones de valencia
el número de enlaces formados, si no da menos de 8, para obtener los
electrones necesarios, EN.
3º Calcular los electrones de valencia disponibles, ED.
Se sumarán los electrones de valencia de todos los átomos de la
molécula, y se tendrán en cuenta también las cargas de los iones, en las
cargas negativas se suman electrones, en las positivas se restan.
4º Calcular los pares enlazantes, PE. A los electrones
necesarios, EN, le restamos los electrones disponibles, ED, dándonos los
electrones que se deben compartir. Dividiendo por 2 obtenemos los pares
de enlace, PE:
5º Calcular los pares no enlazantes, PN. Los electrones
disponibles, ED, menos los electrones que forman pares de enlace, 2·PE,
nos dan los electrones que no enlazan nada, que no contribuyen al
enlace. Dividiendo por 2 obtenemos los pares no enlazantes, PN:
Por ejemplo, calcula la estructura de Lewis para el ozono, O3:
¿Qué estructura podemos proponer para el ozono
según la TRPECV?
Veamos cuál es la estructura real del ozono:
Estructura del ozono (Wikipedia).
Si contamos los electrones que asignamos a cada átomo en la
estructura, con respecto a los electrones de valencia que debería
tener, podemos calcular la carga formal sobre cada átomo.
Para contar los electrones sobre cada átomo contaremos uno por cada
par de enlace y dos por cada par no enlazante.
Si el número de electrones alrededor del átomo es mayor que el
número de electrones de valencia hay exceso de electrones. La carga
formal será negativa e igual al número de electrones en exceso.
Si el número de electrones alrededor del átomo es menor que el
número de electrones de valencia hay defecto de electrones. La carga
formal será positiva e igual al número de electrones en defecto.
Si el número de electrones alrededor del átomo es igual al número
de electrones de valencia no hay ni exceso ni defecto de electrones. La
carga formal será cero.
La suma de todas las cargas formales debe ser igual a la carga total
del compuesto.
Si podemos proponer varias estructuras para un compuesto será más
probable la que presente menores cargas formales sobre sus átomos.
Se sabe que en la molécula de ozono los enlaces son iguales, pero en
la estructura de Lewis propuesta los enlaces son diferentes, uno
sencillo y otro doble. Una solución a este problema es proponer más de
una estructura posible para una sustancia, estructuras que llamaremos estructuras
resonantes. La estructura real será una mezcla entre las
estructuras resonantes, que llamaremos híbrido de resonancia.
Hay átomos en algunos compuestos que no tienen electrones
suficientes para completar el octeto, como le pasa al B en el BF3.
Otros compuestos tienen átomos que pueden presentar más de cuatro
enlaces, se dice que tienen el octeto expandido. Son átomos que
disponen de orbitales d que también pueden utilizar en la formación de
enlaces, como le ocurre al S en el SF6, y a otro elementos
del tercer período y superiores.
TRPECV significa Teoría de repulsión de los pares electrónicos
de la capa de valencia. Este modelo intenta explicar la geometría
de las moléculas a partir de las estructuras de Lewis. Predice la
geometría molecular y los ángulos de enlace suponiendo que los pares
electrónicos, ya sean de enlace como no enlazantes, se deben disponer
en una geometría que minimice las fuerzas repulsivas entre los mismos.
Para determinar la estructura, los enlaces dobles y triples, cuentan como
si fueran sencillos.
| Pares electrónicos |
Disposición de los pares |
Ángulos |
Ejemplos |
| 2 |

Lineal
|
180º |
BeF2
CO2
|
| 3 |

Trigonal plana
|
120º |
BF3
SO3
|
| 4 |

Tetraédica
|
109º |
CH4, NH3,
H2O |
| 5 |

Bipiramidal trigonal
|
120º y 90º |
PCl5 |
| 6 |

Octaédrica
|
90º |
SF6 |
Construye moléculas y observa su geometría
utilizando esta simulación de la Universidad de Colorado:
En MODELO, puedes construir moléculas añadiendo pares de enlace y
pares no enlazantes al átomo central. También puedes eliminar pares.
Puedes mostrar los ángulos de enlace, observa como varían los ángulos de
enlace en función del número de pares. También te da el nombre de la
geometría de pares y de la geometría molecular. En MOLÉCULAS REALES
tienes algunos ejemplos de moléculas. Alternando entre la estructura
real y el modelo puedes observar el efecto que producen los pares no
enlazantes sobre la geometría molecular.
EJERCICIOS
PARA PRACTICAR
 |
|
ENLACE COVALENTE. POLARIDAD
DE LOS ENLACES
|
|
Cuando dos átomos iguales se unen mediante un enlace covalente los
dos átomos atraen igualmente a los electrones del enlace. El centro de
la carga positiva y negativa en la molécula es el mismo. Esto pasa en
el H2, N2, o Cl2.
Pero qué ocurre si los átomos unidos por un enlace covalente son
distintos, como ocurre por ejemplo en el HCl. Si dos átomos distintos
se unen por un enlace covalente siempre uno atraerá más los electrones
del enlace que el otro. El átomo más electronegativo atraerá más a
los electrones del enlace produciendo una separación de cargas. Sobre
el cloro habrá una cierta carga parcial negativa y sobre el hidrógeno
una cierta carga parcial positiva, ya que el cloro es más
electronegativo que el hidrógeno. Esta separación de cargas creará un
momento dipolar de enlace.
El momento dipolar es un vector que viene dado por el producto de la
carga efectiva sobre cada átomo y la distancia que las separa. El
sentido de este vector apunta hacia el átomo más electronegativo.
Una molécula es polar si cumple dos condiciones:
1º Si
tiene enlaces polares, es decir, si tiene enlaces entre átomos distintos,
y
2º si estos dipolos no se anulan por simetría.
La molécula de agua, presenta enlaces polares y como es
angular estos dipolos de enlace no se anulan por simetría,
sino que se suman vectorialmente para dar un vector
momento dipolar total distinto de cero. El H2O es una
molécula polar.
La molécula de CO2, también presenta enlaces
polares, pero estos se anulan por simetría, de forma que el momento
dipolar total es cero. El CO2 es una molécula apolar.
¿Cómo sabemos que dipolos de enlace se anulan por simetría? Depende del número
de enlaces iguales que rodeen a un átomo central y de los ángulos que
formen. Los tienes en esta tabla:
|
SE ANULAN
POR SIMETRÍA LOS SIGUIENTES DIPOLOS DE ENLACE |
| Dipolos de enlace iguales |
Disposición de los dipolos
de enlace |
Ángulos |
| 2 |

Lineal
|
180º |
| 3 |

Trigonal plana
|
120º |
| 4 |

Tetraédica
|
109º |
| 5 |

Bipiramidal trigonal
|
120º y 90º |
| 6 |

Octaédrica
|
90º |
EJERCICIOS
PARA PRACTICAR
 |
|
ENLACE COVALENTE.
TEORÍA DE ENLACE DE VALENCIA (TEV)
|
|
Es un modelo propuesto en 1927 por Walter Heitler y
Fritz London
 |
 |
|
Walter Heinrich Heitler
(1904 - 1981) |
Fritz Wolfgang London (1900
- 1954) |
y desarrollado luego por Linus Pauling y J. C. Slater.
 |
 |
|
Linus Carl Pauling (1901 -
1994) |
John C. Slater (1900 -
1976) |
Se basa en el solapamiento de los orbitales atómicos de los átomos. Los
átomos forman enlaces cuando solapan sus orbitales atómicos, estos
orbitales tienen que estar semiocupados, tienen que tener electrones
desapareados, para formar enlaces, o si uno está lleno el otro tiene que
estar vacío. Veamos que posibles solapamientos pueden dar algunos
orbitales atómicos cuando forman enlaces:
|
SOLAPAMIENTO ENTRE
ORBITALES |
| orbital s +
orbital s |
 |
| orbital s +
orbital p |
 |
| orbital p +
orbital p (longitudinal) |
 |
| orbital p +
orbital p (paralelos) |
 |
Los enlaces, o solapamientos, pueden tener simetría sigma, σ, si el solapamiento tiene lugar en la zona
internuclear, o simetría pi, π, si solapan por encima y por debajo de la zona
internuclear.
Veamos como podemos representar algunas moléculas
sencillas con este modelo:
Partimos de las configuraciones electrónicas de los
elementos, relacionamos los orbitales que solapan, y finalmente
dibujamos la molécula con los solapamientos σ y π que
correspondan.
Los orbitales atómicos solapan en unas direcciones
determinadas por su geometría en el átomo. Por ejemplo los tres orbitales p
son perpendiculares, cuando forman enlaces deberían dar geometrías de
enlaces perpendiculares, pero en muchos casos esto no ocurre. Para
justificar la geometría de las moléculas se tuvo que introducir el
concepto de orbital híbrido. Los orbitales atómicos puros de
energías parecidas se pueden combinar para dar un conjunto de orbitales híbridos
que sean todos de igual forma y de igual energía. El número de
orbitales híbridos de cada tipo es igual al número de orbitales
atómicos puros que se combinan.
En el caso del metano, CH4, se sabe que forma
4 enlaces con los hidrógenos, por tanto el carbono debe de promocionar
un electrón desde el orbital 2s a un orbital 2p vacío, para tener la
posibilidad de formar cuatro enlaces, la energía que hay que aportar se
ve de sobra compensada con la energía que aportan los dos nuevos enlaces
que se forman.
| CH4 |
 |
 |
Pero si se usan los orbitales atómicos puros del
carbono, el metano debería tener tres enlaces iguales que se
diferenciarían del formado entre el orbital 2s y el 1s del hidrógeno.
Además los enlaces formados con los orbitales 2p deberían formar ángulos
de 90º, ya que este es el ángulo que forman dichos orbitales. Se sabe
que el metano forma cuatro enlaces iguales, con ángulos tetraédricos, de
109º, entre los mismos. Para justificar este hecho no pueden solapar los
orbitales atómicos puros del carbono.
Los orbitales, como funciones de onda que son, se pueden
combinar linealmente entre ellos para dar un nuevo conjunto de
orbitales. Estos orbitales resultantes se llaman orbitales hibridos:
|
ORBITALES HÍBRIDOS |
| Orbitales híbridos sp |
Cuando se
combinan linealmente un orbital s con un orbital p puros |
|
 |
|
 |
| Se obtienen
dos orbitales híbridos sp, que forman un ángulo de
180º |
|
 |
| Orbitales híbridos sp2 |
Cuando se
combinan linealmente un orbital s con dos orbitales p puros |
|
 |
|
 |
| Se obtienen
tres orbitales híbridos sp2, que forman
ángulos de 120º |
|
 |
| Orbitales híbridos sp3 |
Cuando se
combinan linealmente un orbital s con tres orbitales p puros |
|
 |
 |
| Se obtienen
cuatro orbitales híbridos sp3, que forman
ángulos de 109º |
|
 |
Un orbital s y un orbital p mediante combinación lineal dan un conjunto de
dos orbitales híbridos sp que forman ángulos de 180º, en una disposición lineal.
Un orbital s y dos orbitales p mediante combinación lineal dan un conjunto de
tres orbitales híbridos sp2 que forman ángulos de 120º, en una disposición
trigonal plana.
Un orbital s y tres orbitales p mediante combinación lineal dan un conjunto de
cuatro orbitales híbridos sp3 que forman ángulos de 109º, en una disposición
tetraédrica.
Veamos algunas moléculas sencillas en las que usamos
orbitales híbridos:
|
Metano, CH4 |
| Formación de orbitales
híbridos |
 |
| Solapamiento de orbitales |
 |
| Esquema de la molécula |
 |
|
Eteno, CH2=CH2 |
| Formación de orbitales
híbridos |
 |
| Solapamiento de orbitales |
 |
| Esquema de la molécula |
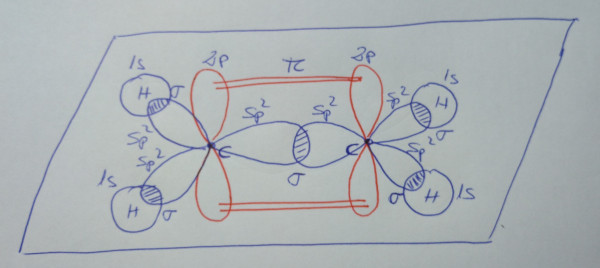 |
|
Etino, HC≡CH |
| Formación de orbitales
híbridos |
 |
| Solapamiento de orbitales |
 |
| Esquema de la molécula |
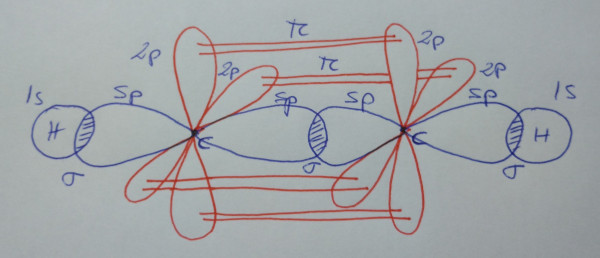 |
¿Cómo saber que orbitales híbridos
usar en cada molécula? Si un átomo central está unido a dos átomos,
con un ángulo de enlace de 180º, geometría lineal, usaremos
orbitales sp, compatibles con esa geometría. La geometría la
puedes predecir a partir de las estructuras de Lewis, y la TRPECV. Si un
átomo central está unido a varios átomos, con ángulos de enlace de
120º, geometría de pares triangular plana, usaremos orbitales sp2.
Si un átomo central está unido a varios átomos, con ángulos de enlace de
109,5º; geometría de pares tetraédrica, usaremos orbitales sp3.
Por eso es importante que te manejes bien con las estructuras de Lewis y
la TRPECV.
EJERCICIOS
PARA PRACTICAR

|
|
ENLACE
COVALENTE.
TEORÍA DE ORBITALES MOLECULARES (TOM)
|
|
Como ampliación unos pequeños apuntes sobre
orbitales moleculares. Otro enfoque del enlace covalente nos los proporciona la
Teoría de Orbitales Moleculares (TOM). Desarrollada por
Friedrich Hund y Robert Mulliken entre 1928 y 1931.
 |
 |
|
Friedrich Hund (1896 -
1997) |
Robert Mulliken (1896 -
1986) |
Según la TEV los electrones de cada
átomo pertenecen al mismo átomo, y los orbitales que los describen son
los que solapan para dar los enlaces, pero según la TOM los electrones
pertenecen a la molécula, las moléculas son sistemas multinucleares que
afectan a todos los electrones. Matemáticamente es una situación más
compleja que la anterior, se tienen que utilizar métodos aproximados
para resolver la ecuación de ondas para la molécula. El método CLOA
(Combinación Lineal de Orbitales Atómicos) permite obtener los orbitales
moleculares, orbitales que afectan a toda la molécula, como combinación
lineal de los orbitales atómicos de los átomos. Los
orbitales moleculares se obtienen por combinación lineal de los
orbitales atómicos, dos orbitales atómicos dan dos orbitales
moleculares, uno de ellos enlazante, refuerza la densidad
electrónica entre los núcleos, y otro antienlazante, disminuye la
densidad electrónica entre los núcleos. Los orbitales enlazantes
contribuyen al enlace, los antienlazantes todo lo contrario.
Veamos que orbitales moleculares encontramos al combinar algunos
orbitales atómicos:
|
ORBITALES ATÓMICOS |
ORBITALES MOLECULARES |
TIPO |
 |
 |
Orbital antienlazante: disminuye la densidad
electrónica entre los núcleos. |
 |
Orbital enlazante: aumenta la densidad electrónica
entre los núcleos. |
 |
 |
Orbital antienlazante: disminuye la densidad
electrónica entre los núcleos. |
 |
Orbital enlazante: aumenta la densidad electrónica
entre los núcleos. |
 |
 |
Orbital antienlazante: disminuye la densidad
electrónica entre los núcleos. |
 |
Orbital enlazante: aumenta la densidad electrónica
entre los núcleos. |
Los orbitales sin asterisco son orbitales enlazantes,
contribuyen al enlace, los que tienen asterisco son antienlazantes, no
contribuyen al enlace. Para describir las moléculas
realizamos unos diagramas donde aparecen los orbitales atómicos de cada
átomo y los orbitales moleculares de la molécula. Estos orbitales se
distribuyen en un diagrama de energía. Los electrones disponibles en los
orbitales atómicos se situarán en los orbitales moleculares de menor a
mayor energía.
|
MOLÉCULA DE H2 |
|
 |
El orden de enlace será:
En este caso el orden de enlace es 1, como sabemos
corresponde a la molécula de H2.
|
MOLÉCULA DE O2 |
|
 |
En el caso de la molécula de O2, el orden de
enlace es 2, como es sabido. Pero la TOM nos proporciona una información
muy importante para el O2, se sabía que las moléculas de O2
son paramagnéticas, por tanto deberían tener electrones desapareados,
ahora en este modelo somos capaces de explicar este fenómeno que se da
en otras moléculas también, y que no era fácil de explicar con los
modelos anteriores. Por último, recuerda que el número de
orbitales moleculares es siempre igual al número de orbitales atómicos
que combinamos. 
|
|
ENLACE
COVALENTE.
PROPIEDADES DE LOS COMPUESTOS COVALENTES |
|
Las sustancias covalentes pueden ser moléculas o
cristales covalentes, es decir, redes cristalinas donde todos los
enlaces son covalentes. Dependiendo de cada tipo de sustancia tendremos
diferentes propiedades:
|
PROPIEDADES DE LAS
SUSTANCIAS COVALENTES MOLECULARES |
| Propiedad |
Característica |
¿Por
qué? |
| Estructura |
Moléculas de un determinado número
de átomos |
Los átomos comparten electrones
dando lugar a enlaces covalentes que los unen formando agregados que
llamamos moléculas. |
| Estado
físico |
Gas, líquido o sólido |
Las moléculas más pequeñas suelen
dar lugar a gases a no ser que las interacciones intermoleculares
sean grandes. |
| Puntos de
fusión y ebullición |
Bajos |
En general las fuerzas entre
moléculas son débiles. |
| Dureza |
Blandas |
Debido a las débiles fuerzas
intermaleculares. |
| Solubilidad |
Las sustancias polares se disuelven
en disolventes polares, como el agua, y las sustancias apolares se
disuelven disolventes apolares. |
La solubilidad depende de la
polaridad de las moléculas, las polares se disuelven en disolventes
polares y las apolares en disolventes apolares. |
| Conductividad
eléctrica |
En general no son conductoras |
Los electrones de los enlaces están
localizados y carecen de cargas que se puedan desplazar. |
| Ejemplos |
Agua, H2O |
 |
|
Sacarosa, C12H22O11
(azúcar de mesa) |
 |
|
Azufre, S |
 |
| Otros: O2, N2,
CH4, C6H12O6,
CH3CH2OH |
|
PROPIEDADES DE LAS
SUSTANCIAS COVALENTES CRISTALINAS |
| Propiedad |
Característica |
¿Por
qué? |
| Estructura |
Redes cristalinas covalentes |
Los átomos comparten electrones
dando lugar a estructuras cristalinas formadas por enlaces
covalentes |
| Estado
físico |
Sólido |
Debido a la fortaleza de los enlaces
covalentes, cuesta mucho romperlos |
| Puntos de
fusión y ebullición |
Muy altos |
La interacción entre los átomos en
la red es muy fuerte |
| Dureza |
Muy duras |
Son las sustancias más duras que
conocemos debido a la fortaleza de los enlaces que las forman |
| Solubilidad |
Insolubles |
Los disolventes no son capaces de
romper los enlaces covalentes que las forman |
| Conductividad
eléctrica |
En general no son conductoras, aunque
el grafito sí es conductor |
Los electrones de los enlaces están
localizados y carecen de cargas que se puedan desplazar. Aunque
algunas sí presentan conductividad como el grafito. |
| Ejemplos |
Cuarzo, SiO2 |
 |
|
Silex, roca que contiene sílice SiO2,
muy apreciada en la prehistoria para la fabricación de útiles de
piedra. |
 |
| Otros ejemplos: C(grafito), C(diamante), carborundo SiC |
Si sois aficionados a los minerales sabréis que están
formados por sustancias cristalinas iónicas o covalentes. Observa este
vídeo para saber como se forman en la naturaleza los cristales de estos
minerales:
EJERCICIOS
PARA PRACTICAR

|
|
ENLACE METÁLICO. MODELO
DEL GAS ELECTRÓNICO |
|
Enlace metálico: se da entre átomos metálicos. Son todos sólidos con la excepción del
mercurio que es líquido a temperatura ambiente. Presentan índices de
coordinación muy altos, frecuentemente 12, es decir, cada átomo metálico se
rodea a una distancia mínima de otros doce átomos metálicos. 6 en un plano,
3 sobre ese plano, y 3 más por debajo del plano, en una estructura que se
denomina hexagonal compacta.
Estructuras de las redes metálicas: Podemos distinguir en los metales tres
redes de diferente estructura:
- Red cúbica centrada en el cuerpo (CC). Por ejemplo:
hierro alfa, vanadio, cromo, titanio, molibdeno, wolframio.
- Red cúbica centrada en las caras (CCC). Por ejemplo:
hierro gamma, cobre, aluminio, oro, plata, plomo, níquel.
- Red hexagonal compacta (HC). Por ejemplo: magnesio,
cinc, cadmio.
Las diferencias entre estas estructuras las puedes encontrar en estos
vídeos:
Los metales se caracterizan por tener estructuras muy compactas y altas
densidades, sus átomos deben estar muy juntos. Entre sus propiedades
características están la alta conductividad eléctrica y conductividad térmica. Dado que
los electrones de valencia de los metales se pueden mover con facilidad de unos
átomos a otros, debido a sus bajos potenciales de ionización. Podemos
suponer un modelo en el que los átomos se distribuyen en estructuras
cristalinas compactas y los electrones de valencia se desplazan entre ellos con
facilidad, es lo que se denomina el modelo del gas electrónico, o del mar
de electrones.
Si aislamos los electrones de valencia, en los átomos metálicos, el
restos que queda es un catión metálico, por eso al representar este
modelo se dibuja una estructura de iones metálicos positivos, entre la
que se mueven los electrones de valencia. Pero hay que tener cuidado con
esta representación, pues no existen tales iones, recuerda que para que
haya un ión positivo, que pierde electrones, tiene que haber iones
negativos, que los ganen, como ocurre en los compuestos iónicos. Los
electrones que se mueven en la red cristalina siempre están en contacto
con los átomos metálicos, de forma que no hay tales iones, sólo es una
forma de representar el átomo, dibujando la nube de electrones de
valencia y el resto del átomo.
Este modelo también explica las propiedades de ductilidad,
facilidad para formar hilos, y maleabilidad, facilidad para formar láminas muy
finas, que presentan los metales. Al no haber repulsiones, ni enlaces fuertes
que haya que romper entre los átomos, el gas electrónico que los envuelve
favorece su desplazamiento entre los mismos.
Recuerda que aunque a veces se represente este modelo como una estructura de cationes
metálicos rodeados de un mar de electrones, no existen propiamente estos
cationes, no es un modelo iónico, tampoco lo es covalente, compartiendo los
electrones con átomos próximos. En todo caso debemos de entender que todos los
átomos metálicos comparten, entre todos, sus electrones de valencia.

|
|
ENLACE METÁLICO.
TEORÍA DE BANDAS |
| La teoría de bandas surge de aplicar la TOM a las
estructuras metálicas. Los orbitales atómicos se combinan para dar un
conjunto de orbitales moleculares. El gran número de orbitales
moleculares a considerar hace que se formen bandas con un número inmenso
de niveles de energía. Los niveles de energía están muy juntos, de forma
que los electrones se pueden mover fácilmente entre ellos dentro de una
banda. Si tenemos N orbitales atómicos, en N átomos de un metal, según
la TOM obtendremos, por combinación lineal, un conjunto de N orbitales
moleculares de diferentes energías, pero debido al número tan alto de
orbitales los niveles de energía de los orbitales moleculares estarán
muy juntos, formando lo que llamaremos una banda de niveles de
energía.
Imaginemos que tenemos un metal con un solo electrón en los orbitales
s de la última capa. Los electrones formarán parte de una banda semiocupada, el resto de la banda está vacía. Estos electrones podrán
moverse por el resto de la banda semiocupada.
Además en los metales es frecuente que las bandas formadas por los
orbitales s solapen con las bandas formadas con los orbitales p,
favoreciendo así, aún más, el movimiento de electrones por la red
cristalina metálica. En este caso los electrones también pueden moverse
por la banda vacía, ya que la diferencia entre niveles es mínima.
Si el metal tiene dos electrones en los orbitales s, la banda estará
totalmente ocupada, pero la conducción es posible si solapa esta banda
con la banda formada por los orbitales p. La banda ocupada se conoce
también como banda de valencia, y la banda vacía como banda de
conducción. Los electrones tienen facilidad para pasar de la
banda de valencia a la banda de conducción, sólo precisan un aporte
mínimo de energía. Esto explica la alta conductividad eléctrica y
térmica de los metales.
En los elementos semiconductores, que están en la diagonal que
divide a metales con no metales, la diferencia de energía entre la
banda ocupada y la banda vacía es pequeño. Una pequeña cantidad de
energía hace que estos elementos conduzcan la corriente eléctrica. Esto
ocurre en elementos como el Si, Ge, Ga. Los electrones pueden saltar
de la banda de valencia a la banda de conducción con un aporte pequeño
de energía.
Para favorecer la conductividad de los semiconductores se someten a
un proceso de dopado, que consiste en adulterarlos con pequeñas
cantidades de otro metales con diferente número de electrones de
valencia. El siguiente esquema corresponde a cuando el silicio se dopa
con galio. El galio tiene menos electrones de valencia que el silicio,
de forma que la banda ocupada ahora tiene un pequeño defecto de
electrones que favorecen la conductividad. Este semiconductor se dice
que es de tipo p. Esta p indica que al haber defecto de
electrones es como si hubiera más carga positiva de la que debía
haber.
El siguiente esquema corresponde a cuando el silicio se dopa con
arsénico. El arsénico tiene más electrones de valencia que el silicio,
de forma que la banda vacía ahora tiene una pequeña cantidad de
electrones que favorecen la conductividad. Este semiconductor se dice
que es de tipo n. Esta n indica que al haber exceso de electrones
es como si hubiera más carga negativa de la que debía haber.
Estos semiconductores tipo n y p se usan en las placas solares
fotovoltaicas,
observa en este vídeo como funcionan:
En las sustancias aislantes la diferencia entre la banda ocupada y la
banda vacía es muy grande y por tanto no habrá conductividad eléctrica,
esto ocurre por ejemplo en el diamante y otros sólidos cristalinos
covalentes. El espacio que separa la banda ocupada, o banda de valencia,
y la banda vacía, o banda de conducción, se conoce como banda
prohibida, o banda gap, (en inglés bandgap, o brecha
energética). En los conductores esta banda prohibida no existe, al
solapar las bandas de valencia y conducción, en los semiconductores esta
banda gap es muy pequeña, dificultando la conducción eléctrica, y en los
aislantes esta banda gap es muy grande, impidiendo la conductividad
eléctrica.

|
|
ENLACE
METÁLICO.
PROPIEDADES DE LOS COMPUESTOS METÁLICOS |
|
PROPIEDADES DE LAS
SUSTANCIAS METÁLICAS |
| Propiedad |
Característica |
¿Por
qué? |
| Estructura |
Redes cristalinas metálicas |
Los átomos metálicos forman
estructuras muy compactas con altos índices de coordinación |
| Estado
físico |
Sólido (el Hg es líquido) |
Los altos índices de coordinación
hacen que estas estructuras sean sólidas. |
| Puntos de
fusión y ebullición |
Medios y altos |
Hay metales que funden fácilmente
como Sn o Pb y otros que solo lo hacen a altísimas temperaturas
como W u Os |
| Dureza |
Variable |
Algunos son muy blandos como el Na
que se corta con cuchillo, o el Pb, y otros presentan gran dureza
dependiendo de la fortaleza del enlace. En general son dúctiles y
maleables. |
| Solubilidad |
Insolubles en agua, pero solubles en
otros metales formando aleaciones, y en Hg formando amalgamas.
También muchos se disuelven bien en ácidos. |
Las moléculas de agua no los disuelven
pero los ácidos oxidan muchos átomos metálicos a cationes que
así pasan a la disolución. |
| Conductividad
eléctrica |
Son muy buenos conductores |
Los electrones libres de la red
cristalina favorecen la conductividad eléctrica y térmica de los
metales. |
| Ejemplos |
Oro, Au. |
 |
|
Mercurio, Hg, único metal líquido a
temperatura ambiente |
 |
|
Aluminio, Al; Hierro, Fe; Latón,
aleación de Cu y Zn. |
 |
Os dejo aquí unos vídeos interesantes sobre dos metales curiosos. Uno
el mercurio, Hg, el único metal líquido a temperatura ambiente. Otro el
wolframio, W, de los metales más densos que existen.
EJERCICIOS
PARA PRACTICAR
 |
|
FUERZAS INTERMOLECULARES |
|
Ya vimos que las sustancias covalentes moleculares podían presentarse en
los tres estados: sólido, liquido y gas. Que aparezcan en uno u otro
estado depende de las interacciones entre moléculas. Estas interacciones entre
moléculas son un tipo de enlace que llamaremos enlaces débiles, o
fuerzas intermoleculares, para diferenciarlos
de los enlaces fuertes: iónico, covalente y metálico.
Estos enlaces entre moléculas pueden ser de dos tipos: Fuerzas de Van der Waals y
enlaces de hidrógeno.
- Las fuerzas de Van der Waals pueden ser de varios tipos:
- Fuerzas de dispersión de London, o fuerzas dipolo instantáneo - dipolo
inducido.
- Fuerzas dipolo - dipolo inducido, o fuerzas de Debye.
- Fuerzas dipolo - dipolo, o fuerzas de Keesom.
Las fuerzas de dispersión de London, o fuerzas dipolo instantáneo - dipolo
inducido, justifican los puntos de ebullición más
altos de lo esperable para moléculas apolares como, N2, O2,
o los gases nobles. Estas moléculas apolares no debieran interaccionar, pero
en alguna de ellas se pueden producir dipolos instantáneos. Al moverse los
electrones dentro de la molécula, en algún momento, puede haber más densidad
electrónica en una partes que en otras de la molécula. Estos dipolos
instantáneos, que tendrán una duración muy corta, inducen en
las que están próximas dipolos inducidos, estos dipolos formados
interaccionan en breves intervalos de tiempo, aumentando los puntos de
ebullición. En los instantes posteriores estos dipolos desaparecen, las
moléculas volverán a ser apolares, por lo que estas interacciones son muy
débiles.
Las fuerzas dipolo - dipolo inducido, o fuerzas de Debye, tienen lugar al interaccionar
moléculas polares con moléculas apolares, como el H2O (polar)
con el CO2 (apolar).
Las fuerzas dipolo - dipolo, o fuerzas de Keesom, son las más intensas de las tres,
las dos moléculas deben de ser polares. Es el caso
de interacción entre moléculas de HCl, por ejemplo.
- El enlace de hidrógeno, o enlace por puentes de hidrógeno, se produce
en moléculas que contienen átomos de pequeño tamaño, muy
electronegativos y con pares no enlazantes, como el F, O y N, unidos a
átomos de hidrógeno, como ocurre en el HF, H2O y NH3.
Las moléculas de agua presentan enlaces polares O-H, podemos representar
una cierta carga parcial negativa sobre el oxígeno y una cierta carga
parcial positiva sobre el hidrógeno. Estas cargas parciales y los pares no
enlazantes sobre el oxígeno, permiten pensar que se debilita el enlace entre
el oxígeno y los hidrógenos de la molécula, y se crea un enlace parcial
entre el oxígeno de una molécula y los hidrógenos de otras, de forma que los
hidrógenos hacen de puente entre dos átomos de oxígeno, creándose unos
enlaces parciales, que deben tener una componente covalente, como propuso
Pauling, y recientemente se ha demostrado. Estas interacciones estarían
entre las fuerzas de Van der Waals y los enlaces covalentes. Los enlaces de
hidrógeno también son los responsables de la estructura de muchas proteínas
(seda, seda de araña, queratina), polisacáridos estructurales (celulosa,
quitina), y algunos polímeros sintéticos (poliamidas).
En las moléculas de ADN los enlaces de hidrógeno son los responsables
de los emparejamientos entre Timina-Adenina y Citosina-Guanina, en los
que se forman 2 y 3 enlaces de hidrógeno respectivamente.
La interacción por enlace de hidrógeno es mucho más
fuerte que las interacciones dipolo-dipolo. El enlace de hidrógeno es la
justificación de los altos puntos de ebullición del HF, H2O y
NH3 frente a
los demás compuestos de hidrógeno de sus grupos, en los que las
interacciones son dipolo - dipolo. Observa el siguiente gráfico
que nos representa los puntos de ebullición de los compuestos de
hidrógeno.
En los compuestos de hidrógeno de los elementos del grupo del carbono
observamos que el punto de ebullición aumenta de una forma, más o menos
lineal desde el C al Sn, estas son moléculas apolares, pero más
polarizables al aumentar el tamaño del átomo central.
Podríamos esperar un comportamiento similar en los demás grupos, que
aunque presentan moléculas polares, vemos que siguen esta misma
variación del punto de ebullición, con la excepción de tres compuestos,
el NH3, el HF y el H2O.
En estos tres compuestos el punto de ebullición es notablemente mayor
que el que se esperaría de comportarse como los demás compuestos de su
grupo. ¿Qué ocurre entonces? Pues que debe haber una interacción entre
las moléculas, en este caso, mayor que la que se explicaría por las
fuerzas de Van der Waals. El enlace de hidrógeno, o enlace por puentes
de hidrógeno, es la interacción que justifica estos altos puntos de
ebullición. El nitrógeno, flúor y oxígeno que forman estos compuestos
tienen unas características que los diferencian de los demás, son átomos
pequeños, electronegativos y con pares no enlazantes. Cuando estén
unidos al hidrógeno pueden presentar enlaces por puente de hidrógeno.
Fíjate que el cloro no forma parte de este selecto grupo, al ser del
tercer período y ser más voluminoso. El carbono tampoco, no es tan
electronegativo, y no presenta pares no enlazantes.
Observa en el gráfico que el H2O, si la interacción que
presentara entre las moléculas fuera similar a las de los compañeros de
grupo, es decir, interacción dipolo-dipolo, su punto de ebullición
debería ser de unos -80ºC. Muy por debajo del real de 100ºC. Eso
significaría que el agua debería ser gas a cualquier temperatura que se
da en la Tierra, o dicho de otro modo, no habría agua líquida en la
Tierra, y por tanto no habría vida en nuestro planeta, por lo menos vida
como la que conocemos. La vida, por tanto, tiene que estar muy
agradecida a los enlaces de hidrógeno, y no solo a los del agua, sino a los
que se dan en otras moléculas como ácidos nucleicos o proteínas, también
moléculas muy ligadas a la vida. No estaría mal hacerle un monumento a
los enlaces por puente de hidrógeno, ¿no te parece?
EJERCICIOS
PARA PRACTICAR

|
|
|
 
|
|
