   |
|
|
|
CLASIFICACIÓN
DA MATERIA |
|
A partir das propiedades dos distintos tipos de materia podémola clasificar en:
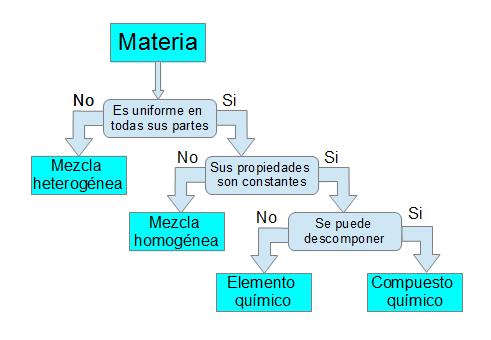
Se a primeira ollada distinguimos diferentes partes nunha sustancia trátase dunha
mestura
heteroxénea. Cando dicimos a primeira ollada tamén podemos usar unha lupa ou
un microscopio. A materia que non é uniforme é unha mestura heteroxénea. A maior parte da materia atopámola neste grupo.
Se as propiedades dunha materia uniforme non son constantes trátase dunha
mestura
homoxénea. As mesturas heteroxéneas non teñen propiedades
características ou específicas constantes, pero as das substancias puras si son
constantes. Así a auga pura ten unha densidade de 1g/cm3, funde a 0ºC e ferve a
100ºC. Se a densidade dunha substancia e os puntos de fusión e ebulición non
coinciden cos da auga, seguro que non é auga.
Se non sabemos se unha sustancia pura (composto ou elemento) pódese descompoñer
podémonos axudar da
Táboa Periódica
dos Elementos, se unha sustancia pura está na Táboa Periódica é un elemento, en caso contrario é un
composto.
EXERCICIOS
PARA PRACTICAR

|
|
MESTURAS
HOMOXÉNEAS |
|
As disoluciones son mesturas homogéneas de dúas ou máis
sustancias. Na vida diaria atopámonos con moitos exemplos de disolucións. Cando temos sede tomamos auga mineral (disolución de sales en auga), pero os teus pais toman unha copa de alvariño (disolución de gran número de sustancias en auga, entre elas alcohol etílico ou etanol), pero cando facemos exercicio tomamos auga con azucre (disolución de auga e azucre) crendo que iso nos vai a quitar as
maniotas, o exercicio tamén nos fai respirar aire (disolución de nitrógeno, osíxeno, e outros gases en menor cantidade) con máis frecuencia. Algún pola contra pagaría un euro (disolución de metais chamada aleación) con tal de non ter que facer exercicio. Peor para el.
Nunha disolución a proporción dos compoñentes pode variar, polo tanto as súas propiedades serán tamén variables. Pero nunha sustancia pura a composición é constante, polo cal as propiedades serán tamén constantes.
As disoluciones compóñense de soluto e disolvente. O soluto é o compoñente que está en menor proporción e o disolvente o que está en maior proporción. Aínda que non sempre é así, hai sales que se disolven tanto en auga que temos máis peso de sal que de auga, pero como a disolución ten o mesmo estado físico que a auga, é dicir líquido, esta será o disolvente.
Podemos atopar disoluciones sólidas, como as aleaciones de metais, disoluciones líquidas, como a auga mineral, e disoluciones gaseosas como o aire.
As disoluciones caracterízanse pola súa concentración, que é a relación entre a cantidade de soluto e a cantidade de disolución.
Disolución diluída: ten moi pouco soluto para unha cantidade de disolución.
Disolución concentrada: ten moito soluto para unha cantidade de disolución.
Disolución saturada: é a que xa non admite máis soluto, ten a cantidade máxima de soluto que pode disolver. Chámase solubilidad á concentración dunha disolución saturada.
Factores a ter en conta na solubilidad:
- En xeral a solubilidad dos gases nos líquidos aumenta coa presión. Que ocorre cando abrimos unha bebida gaseada?
- En xeral a solubilidad dos gases nos líquidos diminúe coa temperatura. Que augas terán máis osíxeno
disolto, as frías augas do Atlántico norte ou as templadas augas do Ecuador? En cal destas zonas hai máis pesca?
- En xeral a solubilidad dos sólidos aumenta coa temperatura. Lávase a roupa igual en auga quente que en auga fría?
- Canto máis dividido estea o soluto máis rápida é a disolución, pois aumenta a superficie de contacto co disolvente. Disólvese mellor o sal fino ou o sal gordo?
- Unha maior axitación aumenta o proceso de disolución. Por que removemos o cacao no leite e a sopa cando engadimos máis sal?
VÍDEO
EJERCICIOS
PARA PRACTICAR

|
|
CONCENTRACIÓN
DUNHA DISOLUCIÓN |
|
As disoluciones compóñense de disolvente e soluto. A composición dunha disolución podémola dar de forma cualitativa dicindo si é diluída ou concentrada, pero si queremos ser máis precisos debemos dar a concentración.
A concentración dunha disolución é a relación entre a cantidade de soluto e a cantidade de disolución.
Dependendo das unidades en que deamos a cantidade de soluto e disolución temos as distintas formas de dar a concentración. Moitas se usan na nosa vida diaria.
Pero antes recoméndoche ver este repaso de ecuacións de primeiro
grao, que che axudará a despexar ben:
REPASO DE COMO DESPEXAR UNHA ECUACIÓN DE PRIMER GRAO.
Concentración en porcentaxe en masa
Esta é a forma de expresar a concentración que tamén aparece nas etiquetas
dos produtos do supermercado. Os compoñentes dun produto ordénanse na etiqueta
en orde decrecente da súa concentración en porcentaxe en masa, nalgúns casos
cuantifícase esta concentración. Vexamos esta etiqueta:
Observa que neste cacao soluble o ingrediente que contén en maior porcentaxe
é o azucre. Se buscamos na información nutricional observamos que a cantidade de
azucre é de 70 g por cada 100 g totais, é dicir do 70% en masa.
Hai marcas que aínda conteñen máis azucre:
Lembra, os ingredientes indícanche os compoñentes ordenados pola porcentaxe
en masa, pero non sempre indican esta porcentaxe:
Podemos atopar as porcentaxes na información nutricional:
EXERCICIOS
PARA PRACTICAR
Concentración en porcentaxe en volume
Esta forma de expresar a concentración aparece nas bebidas alcohólicas, son
equivalentes os graos alcohólicos á porcentaxe en volume. Se unha cervexa é de
6º significa que é do 6% en volume de alcol. Hoxe xa o indican con % vol.
Coidado coas cervexas, as cervexas SEN poden ter ata o 1% de alcol, enganoso
non?
Hai que ser conscientes de que o alcol é un tóxico sexa na cantidade que sexa.
Non é bo para a saúde aínda que sexa en pequenas doses. Pero se observamos os
altos contidos en alcol dalgunhas bebidas compréndese a preocupación que o uso
social do alcol pode ter na saúde das persoas. Ser conscientes do alcol que se
inxere pode ser motivo de reflexión e disuadirnos dun costume social nada sa.
EXERCICIOS
PARA PRACTICAR
Concentración en masa entre volume
Esta forma de concentración tamén é moi común nas etiquetas. Fíxate nas
etiquetas da auga mineral por exemplo. As unidades dependen de en que unidades
expresemos a masa e o volume.
EXERCICIOS
PARA PRACTICAR

|
|
PREPARACIÓN
DE DISOLUCIÓNS |
|
Antes de preparar unha disolución, imos traballar cunha
disolución que todos coñecemos ben aquí en Vigo, a auga de mar. Nela temos auga
e sales minerais, entre as que destaca o cloruro de sodio, NaCl. Non todas as
augas do mar teñen a mesma proporción de sales, así a auga da Ría terá máis ou
menos sal dependendo do preto ou lonxe que esteamos da desembocadura dos ríos
que achegan á mesma, ou de que as choivas acheguen máis ou menos auga doce á
Ría, que é causa frecuente de mortalidade en bancos de moluscos, como ameixas ou
berberechos.
Como podemos medir a cantidade de sal da auga de mar? Tomemos
unha certa cantidade de auga de mar, que mediremos nunha probeta. Introducímola
nun matraz Erlenmeyer previamente pesado, e colocámolo nun hornillo eléctrico,
quentando ata a evaporación total da auga. Cando arrefríe pesámolo co sal que
contén. Por diferenza co peso do matraz baleiro calculamos a masa de sal. Con
esta e o volume de auga de mar medido na probeta calculamos a concentración en
masa entre volume.
Guión PRÁCTICA: DETERMINAR A CONCENTRACIÓN DE SAL EN AUGA DE MAR, EN g/L
- Preparar unha disolución con concentración en porcentaxe en masa.
Para preparar unha disolución de concentración
coñecida, en porcentaxe en masa, debemos medir unha masa de soluto,
coa balanza electrónica, e unha masa de auga, tamén coa balanza. Para pesar
o disolvente podemos usar un vaso de precipitados e axudarnos dun
contagotas. Pero tamén podemos determinar a masa de disolvente medindo un
volume, se coñecemos a densidade. Por exemplo na auga a d = 1g/mL, por tanto
se temos 100 mL de auga terán unha masa de 100g.
Se nos dan a concentración da disolución para
preparar, en porcentaxe en masa, por exemplo 15% en masa, e a cantidade de
disolución a preparar, por exemplo 250g, debemos calcular a masa de soluto
que debemos pesar mediante unha proporción, logo pesámola. Pesamos logo o
disolvente restando a 250g a masa de soluto, ou completamos ata 250g o peso
da disolución con auga. Disolvemos o soluto no
disolvente. Por último gardaremos a disolución nun frasco, cunha etiqueta
que indique a disolución preparada, a concentración da mesma, a data e o
operario ou operarios que a prepararon.
Guión PRÁCTICA: PREPARA
250g DE DISOLUCIÓN DE SAL DE 15% EN MASA
- Preparar unha disolución con concentración en porcentaxe en
volume.
Para preparar unha disolución de concentración
coñecida, en porcentaxe en volume, debemos medir un volume de soluto, coa
pipeta, se é pouco, e coa probeta, se é moito, e un volume de disolución,
cun matraz aforado. Podemos axudarnos dun contagotas para completar o
volume.
Se nos dan a concentración da disolución para
preparar, en porcentaxe en volume, por exemplo 10% en volume, e a cantidade
de disolución a preparar, por exemplo 250mL, debemos calcular o volume de
soluto que debemos medir mediante unha proporción, logo medímolo coa
probeta, ou a pipeta se fose pequeno. Introducimos este volume no matraz
aforado, e engadimos disolvente ata completar o volume ata o nivel de afora.
Por último gardaremos a disolución nun frasco, cunha etiqueta que indique a
disolución preparada, a concentración da mesma, a data e o operario ou
operarios que a prepararon.
- Preparar unha disolución con concentración en masa entre
volume.
Para preparar unha disolución de concentración
coñecida, en masa entre volume, debemos medir unha masa de soluto, coa
balanza electrónica, e un volume de disolución, cun matraz aforado, que é
específico para preparar disolucións.
Se nos dan a concentración da disolución para
preparar, por exemplo 30g/L, e o volume do matraz para preparala, por
exemplo 250 mL, debemos calcular a masa de soluto que debemos pesar, neste
caso 7,5g, logo disolvémola nun volume menor de 250 mL de auga destilada e
introducímola no matraz, por último completamos o volume do matraz, con auga
destilada, ata a liña de enrase. Por último gardaremos a disolución nun
frasco, cunha etiqueta que indique a disolución preparada, a concentración
da mesma, a data e o operario ou operarios que a prepararon.
Guión PRÁCTICA: PREPARA
250mL DE DISOLUCIÓN DE SAL DE 30g/L
EXERCICIOS
PARA PRACTICAR

|
|
TÉCNICAS
DE SEPARACIÓN DE MESTURAS |
|
Os compoñentes dunha mestura, sexa homoxénea ou heteroxénea, pódense separar utilizando diferentes técnicas físicas.
SEPARACIÓN DE MESTURAS HETEROXÉNEAS
FILTRACIÓN: Utilízase para
separar un líquido dun sólido finamente dividido. Podemos utilizar papel de
filtro de diferente poro para realizar a filtración. É o método adecuado para
separar un líquido de partículas sólidas non disoltas.
Que aplicacións desta técnica atopas na vida diaria?
DECANTACIÓN: Utilízase para
separar un líquido de partículas sólidas grosas que se depositan no fondo do
recipiente. Cando as partículas sólidas que hai no líquido son suficientemente
grandes por gravidade vanse ao fondo e podémolas decantar.
Tamén se utiliza para separar líquidos inmiscibles, para o que
utilizamos un embude de decantación. O líquido máis denso ocupa a parte inferior
do embude, regulando a chave podémolo separar do líquido menos denso.
SEPARACIÓN DE MESTURAS HOMOXÉNEAS
DESTILACIÓN: Utilízase para separar os compoñentes dunha disolución ou mestura
homoxénea. Aprovéitase o distinto punto de ebulición dos compoñentes. Para realizala constrúese unha montaxe como
a seguinte:
Que aplicacións desta técnica atopas na vida diaria?
CRISTALIZACIÓN: Utilízase
para separar un soluto sólido do disolvente dunha disolución, aproveitando a
diferenza de volatilidade de ambos. Tamén se pode utilizar para purificar
substancias. Se queremos cristalizar un sal podemos quentar a disolución, o
disolvente se evaporará máis rápido, pero os cristais serán moi pequenos, se
queremos obter cristais grandes mellor deixar que a evaporación se realice
lentamente a temperatura ambiente, aínda que desta forma tardará máis en
formarse cristais, pero serán máis grandes.
Que aplicacións desta técnica atopas na vida diaria?
VÍDEO
EXERCICIOS
PARA PRACTICAR

|
|
AS SALINAS |
De onde se obtén o sal que lle
botamos ás comidas? Non me vale que digades do súper. Onde se produce?
Pódese obter de minas de sal, que son acumulacións de sal de mares arcaicos,
ou de salinas, que é un método industrial tradicional para obter o sal de
ríos ou mares que conteñan altas concentracións de sal. As salinas de ríos
de auga salgada son as salinas de interior, e as demais son as
salinas mariñas ou de litoral. En España temos bos exemplos dunhas e
outras como veremos.
A importancia do sal na antigüidade era
enorme, non só a usabamos como condimento senón como medio de conservación
dos alimentos, pensa nas matanzas que se facían nas aldeas e na conservación
en salgadura da carne, en épocas en que non había frigoríficos. O mesmo
pasaba co peixe, o bacallau salgado seguímolo consumindo hoxe en día.
Pensa que ata a palabra salario, como
paga ou remuneración polo traballo realizado, ten que ver co sal. Os romanos
pagaban aos soldados con sal, segundo a lenda, sexa ou non certa seguro que
o sal foi sempre importante no intercambio comercial debido á súa
importancia para moitos usos. Hoxe a industria química e as estradas, para
evitar as placas de xeo, levan a maior parte da produción, aínda que
produtos como as escamas de sal ou a flor de sal non poden faltar na
actualidade da alta cociña, nin dos supermercados.
Neste vídeo o profesor José Manuel
Crespo, da Universidade Complutense de Madrid, Cóntanos os distintos tipos e
a importancia das salinas:
Se queredes saber máis déixovos este interesante
libro sobre as salinas de Andalucía, coordinado pola Universidade de
Cádiz:
Libro: SALINAS DE ANDALUCÍA (2004) - Junta de Andalucía
Esta obra recolle aspectos moi diversos baixo o
nexo común do sal e as salinas. É o resultado do traballo colectivo de
especialistas de moi distintas disciplinas (historia, etnografía,
xeografía, arqueoloxía, bioloxía…) e ámbitos profesionais (científicos,
técnicos e xestores), coordinado pola Universidade de Cádiz. Mediante
unha lograda aproximación ofrece unha visión integral, imprescindible
para xestionar estes medios.
Entre as súas achegas hai que destacar, pola súa
novidade, as referentes a salinas de interior. O seu carácter marxinal,
se se comparan coas salinas litorais, fixéronas pasar case inadvertidas.
Grazas a esta iniciativa confeccionouse o primeiro inventario de salinas
de interior de Andalucía con, polo menos, 85 explotacións.
No seguinte vídeo explícannos en funcionamento
dunha salina de litoral en Canarias, Salinas de Tenefé, en Punta de
Tenefé (Gran Canaria):
Antigamente as salinas de interior eran as que
fornecían de sal á poboación, hoxe case desapareceron pero quedan
algunhas de forma testemuñal que nos lembran a súa importancia comercial
noutras épocas, como as de Añana, en Araba, ou as de Poza de la Sal, en
Burgos:
Nas Ría Baixas temos comarcas como O Salnés, que
fan referencia ao gran número de salinas que poboaban a costa de Arousa
en épocas pasadas. Na ría de Vigo as Salinas de Ulló, en Vilabóa,
conservan restos que nos contan da súa actividade nos séculos XVII e
XVIII. Ultimamente tamén se atoparon restos de salinas romanas, en pleno
centro de Vigo, na zona do Areal, Centro Salinae, e nas inmediacións da
Guarda as Salinas de O Seixal.
Se queredes saber máis déixovos este libro sobre
as salinas romanas de Ou Areal, Vigo.
Libro: A salina romana de « O Areal », Vigo (Galicia), Juan C. Castro
Carrera
 |
 
|
|
