  
|
|
|
|
ENLACE
QUÍMICO |
|
En el tema anterior empezamos a conocer mejor a los átomos. Vimos cómo
son, de qué partículas se componen y cómo se distribuyen los electrones
en el interior del átomo. En este tema intentaremos dar respuesta a por
qué los átomos casi nunca aparecen aislados en la naturaleza, aparecen
agrupados en pequeños grupos que llamamos moléculas o en grupos inmensos
que llamamos redes cristalinas. Entender como se agrupan los átomos nos
ayuda a entender mejor sus propiedades como substancias.
La razón que hace que los átomos se unan es la razón que mueve todos
los cambios de la naturaleza, los átomos se unen para conseguir más
estabilidad. La mayor parte de los átomos son más estables juntos que
separados. Intentaremos comprender por qué.
Por ejemplo, el oxígeno y el hidrógeno nunca aparecen en la naturaleza
como átomos aislados, los encontramos formando las moléculas gaseosas, O2
y H2 o para nosotros los seres vivos la imprescindible molécula
de agua, H2O. La mayor parte de los elementos de la Tabla
Periódica son metales, bien pues los metales siempre aparecen formando
parte de sales o de redes cristalinas metálicas. El carbono otro querido
elemento para los seres vivos tampoco aparece aislado, aparece en
innumerables moléculas orgánicas, en sales como los carbonatos, en gases
como el CO2, y unido consigo mismo formando redes covalentes en
el grafito y el diamante.
Imagina dos átomos a gran distancia. Si son más estables unidos que
separados cuando se acerquen es porque las fuerzas de atracción serán favorables
para la formación del enlace. ¿Cuáles pueden ser estas fuerzas? pues las
interacciones de los electrones de un átomo con los protones del otro y
viceversa. Pero a medida que se acerquen también estarán sometidos a
fuerzas de repulsión, las establecidas entre los electrones de un átomo y
los del otro, o las interacciones entre los núcleos de los dos átomos.
Llegará un momento en que las fuerzas atractivas se maximizan y las
repulsivas se minimizan, en este momento los núcleos estarán a una
distancia que llamaremos distancia de enlace. Ya no se pueden juntar más
pues se repelerían, ni se pueden separar pues se atraerían. Diremos que
han quedado enlazados.
SIMULACIÓN:
FUERZAS ENTRE ÁTOMOS, en educaplus.org
Llamamos
enlace químico a la interacción que se da entre los átomos cuando se unen
para dar moléculas o redes cristalinas.
Para entender por qué se estabilizan los átomos al formar enlaces es
útil fijarse en los únicos elementos de la Tabla que no tienen tendencia a
asociarse, son tan estables que no necesitan unirse a otros átomos. Son los
gases nobles. No fue fácil descubrirlos pues existen en pequeñas
cantidades en el aire. Hubo que licuar el aire para obtenerlos aislados.
Más fantástica es la historia del helio, He, que fue descubierto antes en
el Sol que en la Tierra.
¿Por qué son tan estables los gases nobles? Lo único que diferencia a
los gases nobles de los demás elementos, como ya vimos en el tema anterior,
es que tienen las capas electrónicas completas, con más propiedad, tienen
8 electrones en la capa más externa, los dos electrones s, y los seis
electrones p. Tener esta configuración ns2 np6
debe de conferir gran estabilidad a los átomos. Esta configuración se
conoce como configuración de gas noble.
Todos los demás átomos tienden a conseguir esta configuración de gas
noble cuando se combinan con otro átomos. Este comportamiento lo
denominamos Regla del octeto: Los átomos cuando se asocian con otros
átomos tienden a ganar, perder o compartir electrones para conseguir
configuración de gas noble.
Bien, ya vimos que para conseguir estabilidad los átomos deben conseguir
configuración de gas noble, y para conseguir esta configuración deben de
ganar, perder o compartir electrones. En función de como se comporten los
átomos para conseguir configuración de gas noble nos van a aparecer tres
tipos de enlace: Enlace iónico, enlace covalente y enlace metálico.

|
|
ENLACE
IÓNICO |
|
Enlace iónico: se da entre átomos o grupos atómicos que tienen
carga eléctrica y llamamos iones. En compuestos binarios, de dos elementos, se
da entre un metal y un no metal. El metal pierde electrones para dar un ion
positivo, o catión, y el no metal gana electrones para dar un ion negativo o
anión. Los cationes o aniones también pueden ser grupos de átomos como ya
veremos. Los compuestos iónicos forman redes cristalinas y son sólidos.
El enlace iónico se forma cuando iones de distintos signos se unen por
fuerzas electrostáticas para dar redes cristalinas.
Los iones pueden ser monoatómicos o poliatómicos. Los iones monoatómicos
pierden o ganan electrones para obtener configuración electrónica de gas
noble. Los iones positivos se llaman cationes y los iones negativos se llaman
aniones. En la red cristalina cada ión de un signo se rodea de iones de signo
contrario para dar una estructura que maximiza las fuerzas atractivas frente a
las repulsivas.
En función de la carga y tamaño de los iones éstos se ordenan en
distintos tipos de redes cristalinas. La que tienes en la imagen es la red
del cloruro de sodio, NaCl. Cada ión Na+ se rodea de 6 iones Cl-,
y cada ións Cl- de 6 iones Na+. Entre los iones no
hay contacto se atraen por fuerzas electrostáticas de Coulomb. En la red cristalina
también hay fuerzas repulsivas entre iones del mismo signo, pero fíjate
que estos están más lejos entre si que los de signo contrario. El balance
entre las fuerzas atractivas y repulsivas en la red cristalina es lo que se
conoce como energía de red.
Hay redes cristalinas con mayor índice de coordinación, o número de
iones que rodean a un ion de signo contrario. El la red del CsCl, cada ion
Cl-, está rodeado por 8 iones Cs+, y cada ion Cs+
está rodeado por 8 iones Cl-.
Cuando los iones no tienen la misma carga, en valor absoluto, no hay el
mismo número de iones que rodean a otro de signo contrario. Por ejemplo en
la fluorita, CaF2, cada ion F- está rodeado de 4
iones Ca2+, y cada ion Ca2+ está rodeado por 8 iones
F-.
¿Cómo se forman los iones? fíjate en la siguiente simulación:
SIMULACIÓN:
ENLACE IÓNICO en educaplus.org
Los iones positivos son metales, que tienen tendencia a perder
electrones, pues así consiguen configuración de gas noble. También pueden
ser iones positivos grupos atómicos como el ion amonio: NH4+.
Los iones negativos son no metales, que tienen tendencia a ganar electrones
para así conseguir configuración de gas noble. También pueden ser iones
negativos grupos atómicos como el ion carbonato, CO32-,
el ion nitrato, NO3-, o el ion sulfato, SO42-.
Las sustancias iónicas son todas sólidas, pero con frecuencia nos
encontramos con sustancias muy frágiles, al ser golpeadas se rompen con
facilidad ya que al desplazarse partes de la red cristalina se pueden poner
en contacto iones con el mismo signo que se repelen.
Cuando las cargas de los iones sean bajas y los iones voluminosos
encontramos muchas sales que son solubles en agua. Pero también encontramos
sales que son muy poco solubles, cuando las cargas de los iones sean altas y
los tamaños de los iones pequeños. El NaCl de sodio que forma parte del
agua del mar es muy soluble, en cambio el CaCO3, que forma parte
de la roca caliza es prácticamente insoluble.
El proceso de disolución de las sales se debe a que las interacciones de
los iones superficiales con las moléculas de agua, que son polares, son
más fuertes que las interacciones de los iones entre si. Los iones se
rodean de moléculas de agua, decimos que están disueltos, y los
representamos de esta forma: Na+(aq)
|
PROPIEDADES DE LAS
SUSTANCIAS IÓNICAS |
| Propiedad |
Característica |
¿Por
qué? |
| Estructura |
Redes cristalinas formadas por iones. |
Los iones de distinto signo se
atraen y se rodean del mayor número de iones de signo contrario. |
| Estado
físico |
Sólidas |
El gran número de iones que forman
la red hace que se presente en estado sólido |
| Puntos de
fusión y ebullición |
Altos |
Los enlaces iónicos son enlaces
fuertes, difíciles de romper. |
| Dureza |
Son duras pero también frágiles |
Son duras porque los enlaces son
fuertes, pero son frágiles pues al golpearlas las capas de iones se
desplazan entrando en contacto iones del mismos signo que se
repelen. |
| Solubilidad |
Son solubles en agua y disolventes
polares |
Las moléculas polares como el agua
rodean los iones y los separan de la red si las fuerzas de
interacción entre el ion y el agua son mayores que entre el ion y
el resto de la red. |
| Conductividad
eléctrica |
Conducen la corriente en disolución
o fundidas |
Para que haya conductividad debe
haber movimiento de cargas, los iones solo se pueden mover cuando
están disueltos o en estado líquido. |
|
Ejemplos |
Cloruro de sodio, NaCl |
 |
|
Sulfato de cobre, CuSO4·5H2O |
 |
|
Calcita, CaCO3 |
 |
EJERCICIOS
PARA PRACTICAR

|
|
ENLACE
COVALENTE |
|
Enlace covalente: se da entre átomos no metálicos. Se caracteriza
porque los átomos comparten electrones. Cuando dos átomos se unen mediante un
enlace covalente cada átomo comparte un electrón con el otro átomo para dar
un par de enlace, en el caso más general. Los compuestos covalentes forman
moléculas y pueden ser gases, líquidos y sólidos.
Los no metales para estabilizarse necesitan ganar electrones para conseguir
configuración de gas noble. Eso es fácil en los compuestos iónicos, porque
hay metales que pueden perder electrones, pero qué pasa cuando los no metales
interaccionan entre ellos, pues que no pueden ganar electrones porque nadie los
quiere perder, así que los comparten para ganar electrones sin que nadie los
tenga que perder.
Imagínate dos átomos de flúor que se aproximan, llega un momento en que
sus nubes electrónicas solapan dando una zona de intersección en la que están
los electrones que se comparten por ambos átomos. El par de electrones que se
comparten es lo que llamamos par de enlace covalente.
Los pares de electrones de la zona de intersección son los pares de enlace,
y los demás pares de electrones son los pares no enlazantes.
Estas estructuras que nos permiten entender como se comparten los electrones
en los enlaces se llaman "estructuras de Lewis".
Para
dibujarlas pintamos los electrones de valencia alrededor de cada átomo. Si sabes
en que grupo está un elemento sabes cuantos electrones de valencia tiene. Podemos
darle formas diferentes a los electrones de diferentes átomos. Con círculos
rodeamos los electrones de un átomo y los que debe compartir para conseguir
configuración de gas noble. Los pares de la zona de intersección son los pares
de enlace y los demás son pares no enlazantes. También podemos sustituir los
pares de electrones con barras para visualizar los enlaces y pares no enlazantes.
Veamos como se dibujan las estructuras de Lewis de varias moléculas sencillas:
Molécula de Cl2
Molécula de N2
Molécula de H2O
Las estructuras de Lewis no sólo nos permiten justificar si una
molécula es estable o no, también nos aporta más información como la
polaridad de los enlaces y la propia estructura de la molécula a través
de la Teoría de Repulsión de los Pares Electrónicos de la Capa de Valencia (TRPECV)
o teoría de Gillespie.
Cuando dos átomos como el Cl y el H forman un enlace, H--Cl, siempre hay
un átomo que atrae los electrones del enlace más hacia él. Se dice que es
más electronegativo. En nuestro caso es el Cl, por lo tanto la molécula de
HCl será polar pues su enlace es polar. Presentará una cierta carga
parcial negativa sobre el cloro y una cierta carga parcial positiva sobre el
hidrógeno.
El conocer si una molécula es polar es importante pues
condiciona sus propiedades, el HCl se disuelve bien en agua porque el agua también
es una molécula polar. La electronegatividad de los átomos es una propiedad
que en la tabla periódica aumenta en la diagonal que va del cesio al
flúor, el flúor es el elemento más electronegativo de la tabla
periódica. Aunque no sepas exactamente que átomo es más electronegativo
en un enlace, piensa que si los dos átomos de un enlace son distintos,
uno será más electronegativo que el otro, y por tanto el enlace será
polar.
Si los enlaces de una molécula son polares no es condición única para
que esa molécula sea polar. Debe tener una geometría adecuada para que los
dipolos de enlace no se anulen por simetría. La molécula de CO2,
tiene enlaces polares pero se anulan por simetría los dipolos de enlace al
ser la molécula lineal.
La siguiente simulación te ayudará a entender la polaridad de las
moléculas:
SIMULACIÓN:
POLARIDAD DE LA MOLÉCULA, en phet.colorado.edu
En Dos átomos, comprueba como varía la polaridad al variar la
electronegatividad de los átomos. Puedes mover la molécula y observar que
sucede al activar un campo eléctrico.
En Tres átomos, comprueba como varía la polaridad al variar la
electronegatividad de los átomos. Puedes mover la molécula y observar que
sucede al activar un campo eléctrico. Observa qué pasa cuando la molécula es
lineal y las electronegatividades de los átomos de los extremos coinciden.
¿Cómo podemos conocer la estructura de una molécula de varios átomos?
La teoría de Lewis nos permite conocer los pares de enlace y no enlazantes
que hay sobre cada átomo de una molécula sencilla. Estos pares se repelen
dando una estructura en la que las repulsiones se minimicen. La Teoría de
Repulsión de los Pares Electrónicos de la Capa de Valencia, TRPECV, o teoría
de Gillespie, nos dice que
los pares enlazantes y no enlazantes al rededor de un átomo deben estar lo
más separados posible para que las repulsiones entre ellos sean mínimas.
Si sobre un átomo hay dos pares de electrones estos tendrán estructura
lineal con ángulos de 180º, si sobre un átomo hay tres pares de
electrones estos tendrán estructura triangular plana con ángulos de 120º,
si sobre un átomo hay cuatro pares de electrones estos tendrán estructura
tetraédrica con ángulos de 109º.
| Pares electrónicos |
Disposición de los pares |
Ángulos |
Ejemplos |
| 2 |
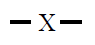
Lineal
|
180º |
BeF2
CO2
|
| 3 |
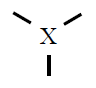
Trigonal plana
|
120º |
BF3
|
| 4 |
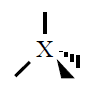
Tetraédica
|
109º |
CH4, NH3,
H2O |
Estas estructuras también te sirven para saber que dipolos de enlace
se anulan por simetría.
| SE ELIMINAN
POR SIMETRÍA LOS SIGUIENTES DIPOLOS DE ENLACE |
| Dipolos de enlace iguales |
Disposición de los dipolos
de enlace |
Ángulos |
| 2 |
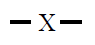
Lineal
|
180º |
| 3 |
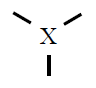
Trigonal plana
|
120º |
| 4 |
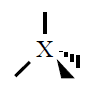
Tetraédica
|
109º |
SIMULACIÓN:
FORMA DE LAS MOLÉCULAS, en phet.colorado.edu
Construye moléculas con hasta cuatro pares, entre enlazantes y no
enlazantes, alrededor de un átomo, y observa las estructuras que se obtienen
para que las repulsiones sean mínimas. En Moléculas reales, puedes
observar la diferencia en los ángulos entre las estructuras reales y el
modelo.
SIMULACIÓN:
CONTRUYE UNA MOLÉCULA, en phet.colorado.edu
En esta simulación, puedes construir moléculas sencillas, y
en Sala se exploración, construir posibles moléculas con los átomos
que te proporcionan. Fíjate en las estructuras 3D de las moléculas.
|
PROPIEDADES DE LAS
SUSTANCIAS COVALENTES MOLECULARES |
| Propiedad |
Característica |
¿Por
qué? |
| Estructura |
Moléculas de un determinado número
de átomos |
Los átomos comparten electrones
dando lugar a enlaces covalentes que los unen formando agregados que
llamamos moléculas |
| Estado
físico |
Gas, líquido o sólido |
Las moléculas más pequeñas suelen
dar lugar a gases a no ser que las interacciones intermoleculares
sean grandes. |
| Puntos de
fusión y ebullición |
Bajos |
En general las fuerzas entre
moléculas son débiles. |
| Dureza |
Blandas |
Debido a las débiles fuerzas
intermaleculares. |
| Solubilidad |
Las sustancias polares se disuelven
en disolventes polares, como el agua, y las sustancias apolares se
disuelven disolventes apolares. |
La solubilidad depende de la
polaridad de las moléculas, las polares se disuelven en disolventes
polares y las apolares en disolventes apolares. |
| Conductividad
eléctrica |
En general no son conductoras |
Los electrones de los enlaces están
localizados y carecen de cargas que se puedan desplazar. |
| Ejemplos |
Agua, H2O |
 |
|
Sacarosa, C12H22O11
(azúcar de mesa) |
 |
|
Azufre, S |
 |
| Otros: O2, N2,
CH4, C6H12O6,
CH3CH2OH |
|
PROPIEDADES DE LAS
SUSTANCIAS COVALENTES CRISTALINAS |
| Propiedad |
Característica |
¿Por
qué? |
| Estructura |
Redes cristalinas covalentes |
Los átomos comparten electrones
dando lugar a estructuras cristalinas formadas por enlaces
covalentes |
| Estado
físico |
Sólido |
Debido a la fortaleza de los enlaces
covalentes, cuesta mucho romperlos |
| Puntos de
fusión y ebullición |
Muy altos |
La interacción entre los átomos en
la red es muy fuerte |
| Dureza |
Muy duras |
Son las sustancias más duras que
conocemos debido a la fortaleza de los enlaces que las forman |
| Solubilidad |
Insolubles |
Los disolventes no son capaces de
romper los enlaces covalentes que las forman |
| Conductividad
eléctrica |
En general no son conductoras, aunque
el grafito sí es conductor |
Los electrones de los enlaces están
localizados y carecen de cargas que se puedan desplazar. Aunque
algunas sí presentan conductividad como el grafito. |
| Ejemplos |
Cuarzo, SiO2 |
 |
|
Silex, roca que contiene sílice SiO2,
muy apreciada en la prehistoria para la fabricación de útiles de
piedra. |
 |
| Otros ejemplos: C(grafito), C(diamante), carborundo SiC |
SIMULACIÓN:
POLARIDAD Y DIFERENCIAS DE ELECTRONEGATIVIDAD, en educaplus.org
SIMULACIÓN:
POLARIDAD DE LOS ENLACES, en educaplus.org
EJERCICIOS
PARA PRACTICAR

|
|
ENLACE
METÁLICO |
|
Enlace metálico: se da entre átomos metálicos. Los átomos
metálicos se unen en estructuras cristalinas muy compactas en las que los
electrones de valencia se pueden mover con mucha facilidad entre los átomos
favoreciendo las propiedades características de los metales como la
conductividad eléctrica y térmica. Son todos sólidos con la excepción del
mercurio que es líquido a temperatura ambiente.
Los metales se caracterizan por tener estructuras muy compactas y altas
densidades, sus átomos deben estar muy juntos. Entre sus propiedades
características están la alta conductividad eléctrica y térmica. Dado que
los electrones de valencia de los metales se pueden perder con facilidad podemos
suponer un modelo en el que los átomos se distribuyen en estructuras
cristalinas compactas y los electrones de valencia se desplazan entre ellos con
facilidad, es lo que se denomina el modelo de la nube electrónica.
|
PROPIEDADES DE LAS
SUSTANCIAS METÁLICAS |
| Propiedad |
Característica |
¿Por
qué? |
| Estructura |
Redes cristalinas metálicas |
Los átomos metálicos forman
estructuras muy compactas con altos índices de coordinación |
| Estado
físico |
Sólido (el Hg es líquido) |
Los altos índices de coordinación
hacen que estas estructuras sean sólidas. |
| Puntos de
fusión y ebullición |
Medios y altos |
Hay metales que funden fácilmente
como Sn o Pb y otros que solo lo hacen a altísimas temperaturas
como W u Os |
| Dureza |
Variable |
Algunos son muy blandos como el Na
que se corta con cuchillo, o el plomo y otros presentan gran dureza
dependiendo de la fortaleza del enlace. En general son dúctiles y
maleables. |
| Solubilidad |
Insolubles en agua, pero solubles en
otros metales formando aleaciones, y en Hg formando amalgamas.
También muchos se disuelven bien en ácidos. |
Las moléculas de agua no los disuelven
pero los ácidos oxidan muchos átomos metálicos a cationes que
así pasan a la disolución. |
| Conductividad
eléctrica |
Son muy buenos conductores |
Los electrones libres de la red
cristalina favorecen la conductividad eléctrica y térmica de los
metales. |
| Ejemplos |
Oro, Au. |
 |
|
Mercurio, Hg, único metal líquido a
temperatura ambiente |
 |
|
Aluminio, Al; Hierro, Fe; Latón,
aleación de Cu y Zn. |
 |
EJERCICIOS
PARA PRACTICAR

|
|
ENLACES
INTERMOLECULARES |
|
Ya vimos que las sustancias covalentes moleculares podían presentarse en
los tres estados: sólido, liquido y gas. Que aparezcan en uno u otro
depende de las interacciones entre moléculas. Estas interacciones entre
moléculas son un tipo de enlace que llamaremos enlaces débiles para diferenciarlos
de los enlaces fuertes: iónico, covalente y metálico.
Estos enlaces entre moléculas pueden ser de dos tipos: Fuerzas de Van
der Waals y enlaces de hidrógeno.
Las fuerzas de Van der Waals pueden ser de varios tipos:
- Fuerzas de dispersión, o fuerzas dipolo instantáneo - dipolo
inducido.
- Fuerzas dipolo - dipolo inducido.
- Fuerzas dipolo - dipolo.
Las fuerzas de dispersión, o fuerzas dipolo instantáneo - dipolo
inducido, justifican los puntos de ebullición más
altos de lo esperable para moléculas apolares como, N2, O2,
o los gases nobles. Estas moléculas apolares no debieran interaccionar, pero
en alguna de ellas se pueden producir dipolos instantáneos que inducen en
las que están próximas dipolos inducidos, estos dipolos formados
interaccionan en breves intervalos de tiempo aumentando los puntos de
ebullición.
Las fuerzas dipolo - dipolo inducido tienen lugar al interaccionar
moléculas polares con moléculas apolares, como el H2O (polar)
con el CO2 (apolar).
Las fuerzas dipolo - dipolo son las más intensas de las tres,
las dos moléculas deben de ser polares, es el caso
de interacción entre moléculas de HCl, por ejemplo.
El enlace de hidrógeno, o enlace por puentes de hidrógeno, se produce
en moléculas que contienen átomos de pequeño tamaño, muy
electronegativos y con pares no enlazantes, como el F, O y N, unidos a
átomos de hidrógeno, como ocurre en el HF, H2O y NH3.
La interacción entre el H y esos átomos electronegativos es mucho más
fuerte que las interacciones dipolo-dipolo. El enlace de hidrógeno es la
justificación de los altos puntos de ebullición del HF, H2O y
NH3 frente a
los compuestos de hidrógeno de sus grupos. Observa el siguiente gráfico
que nos representa los puntos de ebullición de los compuestos de
hidrógeno.
SIMULACIÓN:
CARACTERÍSTICAS DE LOS ENLACES, en educaplus.org
EJERCICIOS
PARA PRACTICAR

|
 
|
|
