|
El modelo de Rutherford, que se conoce como modelo planetario
del átomo, no explica como se mueven los electrones alrededor del núcleo. Por
tanto tenemos la necesidad de plantear un nuevo modelo que dé cuenta del
movimiento de los electrones en el átomo.
Los espectroscopistas en el siglo XIX recopilaron gran
información de los que se conoce como espectros atómicos. Los espectros
atómicos se obtienen al hacer pasar un haz de luz a través de una sustancia y
dispersar esa luz con un prisma. Sobre el espectro de colores de la luz visible
aparecen una serie de rayas negras que se corresponden con diferentes
frecuencias de radiación. Es lo que se conoce como espectros de absorción.
También se obtienen espectros cuando se excitan los átomos de un elemento a
alta temperatura para que emita luz, al dispersar con un prisma esta luz
obtenemos el espectro de emisión, también con rayas de color características de cada
sustancia, las mismas rayas que aparecen en negro en los espectros de absorción. Los espectros de absorción o de emisión son como la huella dactilar
de los átomos.
SIMULACIÓN: VISOR DE ESPECTROS, en educaplus.org
El primer científico que dio una explicación satisfactoria de
los espectros atómicos fue el físico danés Niels Bohr. Propuso un
modelo de átomo en el que los electrones se movían en orbitas en torno al
núcleo.
|
 |
|
Niels Bohr (1885-1962) |
Este modelo se basa en tres postulados:
-
Los electrones describen órbitas circulares en torno al núcleo del átomo sin irradiar energía.
-
Las únicas órbitas permitidas para un electrón son aquellas para las cuales el momento angular, L, del electrón sea un múltiplo entero del valor de la constante de Plank dividida por 2π.
L=n·h/2π
-
El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra.
En dicho cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles.
ΔE=hν- Donde ν es la frecuencia de la radiación. Cuando esta
frecuencia cae en el espectro visible encontramos las rayas de los espectros.
SIMULACIÓN:
MODELO ATÓMICO DE BOHR, en educaplus.org
Este modelo utiliza las ideas de cuantización de la energía
que propuso Plank a principio del XX, y llega a explicar con éxito los
espectros del hidrógeno y átomos hidrogenoides (los que sólo tienen un
electrón). Con átomos polielectrónicos este modelo tiene dificultades, que no
se resolverán hasta la llegada de la mecánica ondulatoria de la mano de Schrödinger y
Heisenberg.
Según este modelo mecanocuántico del átomo los electrones se
distribuyen en orbitales, que son zonas alrededor del átomo en las que
es muy probable encontrar al electrón. Estos orbitales surgen de dos
descubrimientos importantes: 1) que
el electrón se puede comportar en los átomos como partícula y como onda, lo
que se conoce como dualidad onda-partícula, propuesta por el francés Louis-Victor de Broglie
en 1924, y 2) el principio de incertidumbre o indeterminación de Heisenberg
propuesto en 1925, que dice que no podemos conocer con precisión la posición y
la energía del electrón, cuanto más precisión consigamos en el conocimiento
de la posición con menos precisión se conocerá su energía.
Para conocer la configuración electrónica, es decir
cómo se reparten los electrones entre los distintos orbitales, será suficiente
conocer unas pocas reglas que seguirás estudiando y profundizando en cursos
posteriores. Estas reglas se deducen de los números cuánticos que surgen
de resolver las ecuaciones de onda que la mecánica cuántica propone para
explicar el comportamiento de los electrones en el átomo.
1. Los electrones se distribuyen por capas desde la de
más baja energía, la 1, a las siguientes. Esto depende del número
cuántico principal, n. Puede tener los siguientes valores, n = 1,
2, 3,...
2. En cada capa hay distintos tipos de orbitales. Estos pueden
ser orbitales s, orbitales p, orbitales d y orbitales f.
Depende del número cuántico de momento angular, l. Puede tener
los siguientes valores, l = 0, hasta n-1. Si l = 0 orbital s, si l = 1
orbital p, si l = 2 orbital d, si l = 3 orbital f.
SIMULACIÓN:
ORBITALES ATÓMICOS, en educaplus.org
3. En cada capa hay tantos tipos de orbitales como indica el
número de la capa. Así en la capa 1 sólo hay orbitales s, en la 2 orbitales s
y p, en la 3 orbitales s, p y d, y en la 4 orbitales s, p, d y f.
4. En cada capa el orbital s es único, el p aparece en grupos
de 3, el d en grupos de 5 y el f en grupos de 7. Son lo que se conoce como
orbitales degenerados o de misma energía. Depende del número cuántico
magnético, m. Puede tener los siguientes valores, m =
−l,...,0,...,+l
5. En cada orbital sólo caben 2 electrones como máximo.
Depende del número cuántico de spin, s. Puede tener los
siguientes valores, s = +1/2, −1/2
6. En cada capa los orbitales tienen distintas energías, los s
son los de más baja energía, los p los siguientes en energía y le siguen los
d y los f.
7. Para escribir las configuraciones electrónicas de los
átomos, sólo necesitamos saber el número de electrones que tienen y seguir lo que se conoce como la regla de llenado de orbitales.
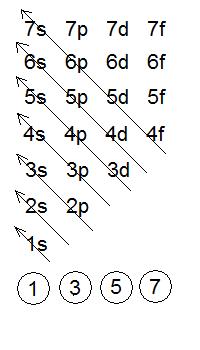
SIMULACIÓN:
CONFIGURACIÓN ELECTRÓNICA, en educaplus.org
Ejemplo 5: Escribe las configuraciones electrónicas de
los siguientes átomos: Li, N, Mg, Cl, Fe, Sn y Hg.
[3Li] = 1s2 2s1
Recuerda que llenamos los orbitales siguiendo las diagonales de
abajo a arriba, y que en cada orbital caben como máximo 2 electrones.
[7N] = 1s2 2s2 2p1
2p1 2p1
Recuerda que los orbitales p siempre aparecen de tres en tres.
Cuando encuentres orbitales de misma energía, como estos 3 orbitales p, se
sigue otra regla, conocida como regla de máxima multiplicidad, y dice que no se
llena un orbital de este conjunto mientras haya orbitales vacíos.
[12Mg] = 1s2 2s2 2p2
2p2 2p2 3s2
[17Cl] = 1s2 2s2 2p2
2p2 2p2 3s2 3p2 3p2 3p1
Los orbitales degenerados debemos escribirlos separados si no
están completos, si están llenos podemos agruparlos, pero recuerda que 2p6
= 2p2 2p2 2p2 y no significa que haya 6
electrones en un orbital 2p. Por eso también podríamos escribir el cloro de
esta forma:
[17Cl] = 1s2 2s2 2p6
3s2 3p2 3p2 3p1
[26Fe] = 1s2 2s2 2p6
3s2 3p6 4s2 3d2 3d1 3d1
3d1 3d1
Recuerda que los orbitales d son 5.
[50Sn] = 1s2 2s2 2p6
3s2 3p6 4s2 3d10 4p6 5s2
4d10 5p1 5p1 5p0
También podemos escribir:
[50Sn] = 1s2 2s2 2p6
3s2 3p6 4s2 3d10 4p6 5s2
4d10 5p1 5p1
[80Hg] = 1s2 2s2 2p6
3s2 3p6 4s2 3d10 4p6 5s2
4d10 5p6 6s2 4f14 5d10
Llamamos electrones de valencia a los electrones de la última
capa electrónica. Estos electrones son muy importantes pues nos van a indicar
el comportamiento químico de los átomos. Fíjate que los elementos que están
en un mismo grupo de la Tabla Periódica tienen el mismo número de electrones
de valencia, cuando Mendeleyev los colocó en grupos es porque tenían
propiedades químicas similares, por tanto podemos pensar que es tener los
mismos electrones de valencia lo que le confiere un comportamiento químico
similar a los átomos de un mismo grupo.
¿Cómo se llaman los distintos grupos de la Tabla Periódica y cuántos
electrones de valencia tienen?
Grupo 1: Metales alcalinos (Li, Na, K, Rb, Cs) 1 e− de valencia.
Grupo 2: Metales alcalinotérreos (Be, Mg, Ca, Sr, Ba) 2 e− de
valencia.
Grupo 3 al 12: Metales de transición.
Grupo 13: Grupo del B (B, Al, Ga, In, Tl) 3 e− de valencia.
Grupo 14: Grupo del C (C, Si, Ge, Sn, Pb) 4 e− de valencia.
Grupo 15: Grupo del N (N, P, As, Sb, Bi) 5 e− de valencia.
Grupo 16: Calcógenos o anfígenos (O, S, Se, Te) 6 e− de
valencia.
Grupo 17: Halógenos (F, Cl, Br, I) 7 e− de valencia.
Grupo 18: Gases nobles (He, Ne, Ar, Kr, Xe) 8 e− de valencia.
La mayoría de los elementos de la Tabla Periódica son metales, los
elementos que están sobre la diagonal que va del B al At son semimetales, y los
elementos que están a su derecha son no metales.
EJERCICIOS
PARA PRACTICAR

|
