         |
|
|
|
LA MATERIA |
|
En física y química vamos a estudiar la materia.
¿Qué nos dice el diccionario de la materia? Materia =
Realidad espacial y perceptible por los sentidos de la que están hechas
las cosas que nos rodean y que, con la energía, constituye el mundo
físico. También nos dice, materia física diferenciada de las demás por
una serie de propiedades determinadas.
Por tanto la materia es todo lo que percibimos por
nuestros sentidos, tiene masa y energía, ocupa un espacio, y aunque sea
invisible para nuestra vista como los gases, los podemos percibir por el
resto de nuestros sentidos.
Es importante que sepas que los distintos tipos de
materia los podemos distinguir por sus propiedades diferentes, para
distinguir estas propiedades necesitamos hacer medidas. Por eso el
proceso de medida será algo importante en este tema. |
|
EL
MÉTODO CIENTÍFICO |
|
Es el método que siguen los científicos para realizar su trabajo, que es
descubrir esas leyes que se esconden en el mundo que nos rodea y nos permiten
entenderlo mejor. Con ellas podremos predecir situaciones nuevas y buscar
aplicaciones tecnológicas que nos hagan la vida más agradable.
Este método se basa en una serie de etapas que habrá que seguir de forma
consecutiva.
1º)
Presentación de un problema a investigar.
Los niños pequeños una de las cosas que primero aprenden a decir es ¿por qué?.
Los científicos también. Sólo que estos lo dicen durante toda la vida. Y no son
fáciles de convencer, parten de la experiencia de la realidad que les proporciona
la
observación.
OBSERVACIÓN: Tratar de extraer
la máxima información, a poder ser
cuantitativa, del fenómeno observado.
-
Tendremos que
MEDIR, para transformar nuestras observaciones en datos
cuantitativos.
-
Emplearemos
APARATOS DE MEDIDA que deberán estar adecuadamente calibrados y manipulados.
-
RECOGIDA DE
DATOS: Recogeremos toda la información complementaria que
podamos, y aprovecharemos otras investigaciones previas o similares.
2º)
Dar una explicación del problema.
Los interrogantes que surgen en el apartado anterior hay que explicarlos mediante
diferentes hipótesis. Es importante no desechar a priori ninguna de las hipótesis.
FORMULACIÓN DE HIPÓTESIS: Una
hipótesis es una suposición que
explica determinado fenómeno y que puede ser comprobada por vía
experimental. Las hipótesis pueden ser válidas o no válidas, serán válidas
cuando se puedan comprobar por medio de experimentos cuantitativos. Las hipótesis
válidas pueden ser verdaderas o falsas, serán verdaderas cuando el resultado
del experimento confirma la hipótesis, si el resultado del experimento contradice
la hipótesis será falsa.
3º)
Comprobar experimentalmente la veracidad de las hipótesis.
EXPERIMENTACIÓN: Primero
aislaremos las variables que influyen en el problema. Luego observaremos que ocurre
al mantener constantes todas las variables
menos dos. ¿Cómo se comporta una cuando varía la otra? Elaboraremos gráficas
para indagar la relación matemática entre las variables. Con esta información
se verá si se verifica la hipótesis o no.
4º) Emisión de
conclusiones.
Redactar el informe de la investigación, con las hipótesis que se aceptan como
verdaderas. Debe recoger el proceso desde la presentación del problema hasta la emisión de
conclusiones.
OBSERVA EL SIGUIENTE VÍDEO:
RESPONDE A LAS
SIGUIENTES PREGUNTAS:
-
¿Cuál es el problema
a resolver y en que observaciones iniciales se basa?
-
¿Cuántas hipótesis se
proponen? ¿Cuáles?
-
¿Qué método se emplea
para la comprobación de las hipótesis?
-
¿El experimento proporciona
resultados satisfactorios de acuerdo con alguna de las hipótesis?
-
¿Sería posible en este caso,
en base al método científico, extraer alguna conclusión?
EJERCICIOS
PARA PRACTICAR

|
|
APLICACIÓN
DEL MÉTODO CIENTÍFICO: PRÁCTICA DEL RESORTE |
|
Nada mejor para entender el Método Científico que practicarlo. Al final del tema
haremos una práctica para aplicar el método científico. Intentaremos descubrir
la relación entre la masa que colgamos de un resorte, o una goma, y el
alargamiento del mismo. Esto ya lo estudió Robert Hook, contemporáneo del gran
Isaac Newton, y con el que no se llevaba muy bien, por cierto, pero no por eso
dejó de ser un físico brillante.
A. OBSERVACIÓN:
En el tema 5 estudiaremos la ley de Hook, que
relaciona la fuerza con el alargamiento de un resorte. Pero eso lo dejaremos
para más adelante, pues tenemos que llegar primero al concepto de fuerza. Lo que
queremos estudiar ahora es la deformación de un resorte, o una goma, cuando
colgamos pequeñas masas. Tenemos también la experiencia que si colgamos una masa
muy grande el resorte o la goma se rompen. La idea es averiguar que relación hay
entre la masa que se cuelga y el alargamiento del muelle o resorte.
Todos tenemos la experiencia de que al colgar un cuerpo de un resorte, o de
un elástico de goma, estos se alargan. También tenemos la experiencia de que
para un mismo resorte o goma, si la masa que cuelga es mayor el alargamiento es
mayor, pero diferentes resortes no tienen por qué alargarse lo mismo. Vamos a
estudiar este fenómeno e intentar llegar a alguna ecuación matemática que nos lo
explique.
Vamos a disponer de diferentes resortes, elásticos de goma y masas, así como
de cintas métricas para medir distancias y balanzas para medir masas.
B. FORMULACIÓN DE HIPÓTESIS:
Queremos saber de qué depende el alargamiento de un resorte o goma cuando
colgamos diferentes masas.
Para plantear las hipótesis debemos de comparar dos variables, intentando que
las demás se mantengan constantes. Las variables en este problema son: la
longitud del resorte, la masa que cuelga y la elasticidad del resorte, o mayor o
menor facilidad para recuperar su forma al ser deformado.
Posible hipótesis:
“Para un mismo resorte o goma la longitud del mismo
cuando colgamos una masa es proporcional a la cantidad de masa que cuelga.”
C. COMPROBACIÓN EXPERIMENTAL DE LA HIPÓTESIS:
Vamos a intentar demostrar la veracidad o no de la hipótesis. Debemos diseñar
un experimento donde sólo intervengan dos variables y las demás magnitudes se
mantengan constantes.
Para demostrar la hipótesis: Colgamos diferentes masas de un mismo resorte de
goma, y medimos la longitud del resorte al colgarlas, con los datos construimos
una tabla de valores.
| m - masa (g) |
|
|
|
|
|
|
| L - longitud (cm) |
|
|
|
|
|
|
Estos valores los representaremos en una gráfica. La masa en abscisas y
la longitud en ordenadas. Une los puntos con la curva o la recta que más
se ajuste a los mismos.
a) ¿Qué forma tiene esta gráfica?
b) Para una masa cero, ¿qué longitud del resorte nos da la gráfica?
¿Coincide con el valor real?
c) Observando la gráfica, ¿qué es proporcional a la masa que cuelga, la
longitud del resorte o lo que se alarga el mismo?
d) ¿Confirma esto la hipótesis?
D. EXTRACCIÓN DE CONCLUSIONES:
e) Podemos cambiar la hipótesis para que se ajuste a la
proporcionalidad que observamos. Por ejemplo: “Para
un mismo resorte o goma el alargamiento del mismo cuando colgamos una
masa es proporcional a la cantidad de masa que cuelga.”
f) Calcula la pendiente de la gráfica con las instrucciones que te dará
tu profesor o profesora.
g) Encuentra la ecuación matemática que relaciona las variables.
h) La pendiente, o constante de proporcionalidad, ¿es siempre la misma,
o depende del resorte? Repite la experiencia con otro resorte distinto.
¿La ecuación que obtienes es la misma?
i) Una ecuación matemática nos es muy útil si nos permite realizar
predicciones. ¿Podrías utilizar esta ecuación para calcular una masa
problema que se cuelgue del resorte?
E. ELABORACIÓN DE UN INFORME:
No olvides elaborar un informe de tu experiencia, Contesta a las preguntas que se te formularon
y redacta las dudas e interrogantes que se te
presentaron durante su realización.
USO DE UNA SIMULACIÓN
Para realizar esta práctica también puedes utilizar esta simulación:
Experimento con la simulación: Vamos a trabajar en el apartado
ESTIRAMIENTO. A) Vamos a usar el resorte 1. Puedes hacer que la fuerza
del resorte sea más pequeña o más grande, pero no la cambies en todo el
experimento, si no es como si cambiaras de resorte. Dispones de tres masas
para colgar, de 50, 100 y 250 g. Marca en el cuadro de la derecha, "Longitud sin
estirar" y "Posición de equilibrio".
Cuelga cada una de estas masas y mide con la regla el alargamiento del
resorte. Construye una tabla con los datos. Calcula la pendiente de la gráfica.
Encuentra la ecuación que relaciona la masa con el alargamiento del resorte.
Tienes tres masa problema, roja, azul y verde. Cuelga estas masas del resorte y
calcula el valor de las masas a partir de la gráfica y de la ecuación que
encontraste. B) Repite el experimento con otro resorte, has de cambiar la
fuerza del resorte.
¿Obtienes los mismos valores para las masas problema?
 |
|
PROCESO
DE MEDIDA |
|
Vamos a plantearnos un
problema: Imagina que todos los de la clase deseamos saber lo altos que
somos. Podríamos utilizar categorías para decir nuestra estatura: Muy
altos, altos, medianos, bajos y muy bajos. Si cada uno clasifica a toda la
clase en estas categorías puede que no coincidiéramos todos, pues son
categorías cualitativas, ser alto puede ser diferente según las
personas. También podemos hacer otra cosa, clasificarnos de más altos a
más bajos, basta con compararnos de dos en dos y ordenarnos en fila.
Puede que en algún caso dudáramos, un compañero puede tener un peinado
más alto que otro, o un calzado con más tacón que otro. Comparar entre
dos personas no es difícil. En el mejor de
los casos llegaríamos a ordenarnos por alturas, pero no podríamos decir
lo que medimos.
Como vemos compararnos es
relativamente fácil, pero sólo nos vale para saber si somos más altos o
más bajos que otro, no podemos dar un valor de esa altura. Para dar un valor
necesitamos compararnos con una altura fija. ¿Se os ocurre algún método
para conseguirlo?
Para medir necesitamos definir
algunas palabras.
¿A qué llamamos magnitudes en física?
MAGNITUD: es cualquier propiedad de un cuerpo que sea medible, es decir,
que se pueda cuantificar o expresar con números.
¿Qué es medir
una magnitud física?
MEDIR es comparar una cantidad de una magnitud con otra cantidad
de la misma magnitud que se toma como patrón (o referencia) y que se denomina UNIDAD.
¿Te fijas como mide la distancia a una barrera el árbitro en un partido? Si la
barrera le parece que está muy cerca del jugador que saca la falta mide con
pasos la distancia a la que debe estar la barrera. Compara la distancia a la que
está la barrera con otra distancia, su paso. Cuando no tenemos una unidad de
medida mejor un paso nos saca del apuro, es una medida aproximada, pero siempre
será mejor una medida aproximada que ninguna medida. Recuerda el verbo
importante es comparar, medir es comparar, ya sabes qué.
¿Cómo elegir
una unidad?
Cuando se
elige una unidad se piensa en una serie de requisitos que es conveniente que cumpla, como :

|
|
SISTEMA
INTERNACIONAL DE UNIDADES |
|
Hasta finales del siglo XIX, cada país utilizaba para medir una misma magnitud
una unidad diferente. Hoy en día, la mayoría de los países acepta el SISTEMA INTERNACIONAL DE UNIDADES (S.I.)
Las unidades
fundamentales del Sistema Internacional:
|
Magnitudes básicas del Sistema Internacional de Unidades |
|
MAGNITUD |
UNIDAD |
SÍMBOLO |
| Longitud |
metro |
m |
| Masa |
kilogramo |
kg |
| Tiempo |
segundo |
s |
| Intensidad de corriente eléctrica |
amperio |
A |
| Temperatura termodinámica |
grado Kelvin |
K |
| Cantidad de sustancia |
mol |
mol |
| Intensidad luminosa |
candela |
cd |
|
DEFINICIONES |
| |
DEFINICIÓN
PREVIA |
DEFINICIÓN
DESDE 2019 |
|
metro |
El metro es la distancia recorrida por la luz
en el vacío en
1/299.792.458 segundos. |
El metro, símbolo m, es la unidad SI de
longitud. Se define al fijar el valor numérico de la velocidad de la luz en
el vacío, c, en 299 792 458, cuando se expresa en la unidad m·s−1,
donde el segundo se define en función de la frecuencia del Cesio ΔνCs.
c = 299 792 458 m·s−1 |
|
kilogramo |
Masa del kilogramo patrón internacional, que se
conserva en Sèvre, cerca de Paris. |
El kilogramo, símbolo kg, es la unidad SI
de masa. Se define al fijar el valor numérico de la constante de Planck, h,
en 6,626 070 15·10−34, cuando se expresa en la unidad J·s,
igual a kg·m2·s−1, donde el metro y el segundo
se definen en función de c y ΔνCs h = 6,626 070
15·10−34 J·s |
|
segundo |
El segundo es la duración de 9.192.631.770
periodos de radiación correspondientes a la transición entre los dos niveles
hiperfinos del estado fundamental del átomo de cesio 133. |
El segundo, símbolo s, es la unidad SI de
tiempo. Se define al fijar el valor numérico de la frecuencia de la
transición hiperfina del estado fundamental no perturbado del átomo de
cesio-133, ΔνCs, en 9 192 631 770, cuando se expresa en
la unidad Hz, igual a s−1. ΔνCs =
9 192 631 770 s−1 |
|
amperio |
El amperio es aquella corriente constante
que, mantenida en dos conductores paralelos rectos de longitud infinita, de
sección circular despreciable, y colocados a 1 m de distancia en el vacío,
produciría entre estos conductores una fuerza igual a 2·10−7
newton por metro de longitud. |
El amperio, símbolo A, es la unidad SI de
corriente eléctrica. Se define al fijar el valor numérico de la carga
elemental, e, en 1,602 176 634 ·10−19, cuando se expresa en
la unidad C, igual a A·s, donde el segundo se define en función de ΔνCs.
e = 1,602 176 634 ·10−19 C |
|
kelvin |
Fracción 1/273,16 de la temperatura termodinámica
del punto triple del agua. |
El kelvin, símbolo K, es la unidad SI de
temperatura termodinámica. Se define al fijar el valor numérico de la
constante de Boltzmann, k, en 1,380 649 ·10−23, cuando se expresa
en la unidad J·K−1, igual a kg·m2·s−2·K−1,
donde el kilogramo, el metro y el segundo se definen en función de h, c y ΔνCs.
k = 1,380 649 ·10−23 J·K−1 |
|
mol |
Cantidad de sustancia de un sistema que
contiene
tantas entidades elementales como átomos hay en 0,012 kg de carbono−12. Se
debe especificar el tipo de las entidades elementales, ya sean átomos,
moléculas, iones, electrones, u otras. |
El mol, símbolo mol, es la unidad SI de
cantidad de sustancia. Un mol contiene exactamente 6,022 140 76 ·1023
entidades elementales. Esta cifra es el valor numérico fijo de la constante
de Avogadro, NA, cuando se expresa en la unidad mol−1,
y se denomina número de Avogadro.
La cantidad de sustancia, símbolo n, de un sistema, es una medida del número
de entidades elementales especificadas. Una entidad elemental puede ser un
átomo, una molécula, un ion, un electrón, cualquier otra partícula o grupo
especificado de partículas.
NA = 6,022 140 76 ·1023 entidades elementales. |
|
candela |
Intensidad luminosa, en una dirección dada, de una fuente que emite una radiación monocromática de frecuencia 540·1012 hercios y cuya intensidad energética en esa dirección es 1/683 vatios por estereorradián. |
La candela, símbolo cd, es la unidad SI de
intensidad luminosa en una dirección dada. Se define al fijar el valor
numérico de la eficacia luminosa de la radiación monocromática de frecuencia
540·1012 Hz, Kcd, en 683, cuando se expresa en la
unidad lm·W−1, igual a cd·sr·W−1, o a cd·sr·kg−1·m−2·s3,
donde el kilogramo, el metro y el segundo se definen en función de h, c y ΔνCs.
Kcd = 683 lm·W−1 |
Magnitudes
derivadas.
Son magnitudes que se definen a partir de las magnitudes fundamentales. Por
ejemplo:



Múltiplos
y submúltiplos:
| Prefijo |
Símbolo |
Factor multiplicador |
| Tera- |
T |
1012 u |
| Giga- |
G |
109 u |
| Mega- |
M |
106 u |
| kilo- |
k |
103 u |
| hecto- |
h |
102 u |
| deca- |
da |
10 u |
| unidad |
u |
1 u |
| deci- |
d |
10-1 u |
| centi- |
c |
10-2 u |
| mili- |
m |
10-3 u |
| micro- |
μ |
10-6 u |
| nano- |
n |
10-9 u |
| pico- |
p |
10-12 u |
El factor multiplicador es el número por el que tienes que multiplicar la
medida para transformarla en la unidad.
Por ejemplo, 2 Mm = 2·106 m o
5 nm = 5·10-9 m
EJERCICIOS
PARA PRACTICAR

|
|
TRANSFORMACIÓN
DE UNIDADES |
|
Las unidades se transforman con facilidad a través de los factores de
conversión.
Consiste en multiplicar una medida por el cociente que nos da la
equivalencia entre la unidad que queremos sustituir y la nueva unidad.
Este
cociente tiene valor unidad, ya que el numerador es equivalente al
denominador.
La unidad que ponemos en el denominador es la que queremos eliminar, y en el numerador
va la nueva unidad.
Cuando escribas la equivalencia entre las unidades dale valor
unidad a la mayor de ellas. Por ejemplo: es más fácil entender 1 km = 1000 m que
1 m = 0,001 km aunque sean las dos igualdades válidas.
Ejemplo 1: Calcula
cuántos km son 245 m:
La equivalencia entre (km) y (m) es: 1 km = 103 m

Las medidas de superficie se miden en m2 y sus múltiplos y
submúltiplos. Estas unidades no varían de 10 en 10 como las unidades de
superficie, varían de 100 en 100. Por ejemplo: 1m2 = 100 dm2
; 1m2 = 10000 cm2
Las medidas de volumen se miden en m3 y sus múltiplos y
submúltiplos. Estas unidades no varían de 10 en 10 como las unidades de
superficie, varían de 1000 en 1000. Por ejemplo: 1m3 = 1000 dm3
; 1m3 = 1000000 cm3
Las medidas de capacidad se miden en litros (L) y sus múltiplos y
submúltiplos. Pero estas unidades también son equivalentes a las unidades de
volumen:
Por ejemplo: 1
m3 = 1 kL; 1 dm3 = 1 L;
1cm3 = 1 mL
El método de los factores de conversión es especialmente útil en el caso de
las unidades derivadas, como ocurre en las unidades de velocidad o de densidad.
Ejemplo 2: Calcula cuántos m/s son 120
km/h.
La equivalencia entre
(km) y (m) es: 1 km = 103 m. Y la
equivalencia entre (h) y (s) es: 1 h
= 3600 s.

Ejemplo 3: Calcula cuántos
km/h son 40 m/s.
La equivalencia entre
(km) y (m) es: 1 km = 103 m. Y la
equivalencia entre (h) y (s) es: 1 h
= 3600 s.

Es importante
también saber pasar de complejo de h:min:s a horas, y viceversa, ya que en la vida diaria nos manejamos en horas, minutos y segundos. Como por ejemplo, cuando abriste esta página eran las:
. ¿Que hacer en estos casos?
Pasar de complejo a incomplejo: ¿Cuántas horas son 2h:25min:30s?
a) Pasa los minutos a horas, y los segundos a horas y suma: 2h:25min:30s = 2h + 25min · 1h/60min + 30s · 1h/3600s = 2,425h
b) O también, aprovechar la tecla (º ' '') de grados, minutos y segundos de la calculadora, que también sigue el sistema
sexagesimal:
2h:25min:30s = 2 (º ' '') 25 (º ' '') 30 (º ' '') = 2,425h
Pasar de incomplejo a complejo: ¿Cuántas h:min:s son 1,755h?
a) Pasa los decimales de horas a minutos, y los decimales de minutos a segundos:
1,755h = 1h + 0,755h · 60min/1h = 1h + 45,3 min = 1h + 45min + 0,3 min · 60s/1min =1h 45min 18s
b) O también, aprovechar la tecla (º ' '') de grados, minutos y segundos de la calculadora, que también sigue el sistema
sexagesimal:
1,755h = 1,755 (º ' '') (=) (º ' '') = 1º 45º 18 = 1h 45min 18s
EJERCICIOS
PARA PRACTICAR

|
|
MATERIAL
BÁSICO DE LABORATORIO |
|
La mayoría de los materiales utilizados en el laboratorio de química son de vidrio por que presentan una serie de ventajas como ser fáciles de limpiar, ser transparentes, ser bastante inertes a los reactivos químicos, y poder usarse
a temperaturas relativamente altas. Frente a esta serie de ventajas tienen un grande
inconveniente: ser muy frágiles, por lo que debes tener mucho cuidado cuando los utilices.
|
 |
VASO DE PRECIPITADOS
Es un recipiente cilíndrico con base plana, y en la parte superior un
pico o labio facilita el vertido de líquidos. Generalmente presenta graduación para la medida aproximada del líquido que contiene,
Se pueden encontrar de 10, 50, 100, 250, 500, 1000 y 2000 ml.
Es el recipiente de uso más frecuente y variado. Sirve para trasvasar
líquidos, calentarlos, mezclarlos, disolver sustancias, realizar
reacciones químicas, y muchos más usos. |
 |
MATRAZ ERLENMEYER
Es un recipiente de forma troncocónica con una boca en la parte superior. Presenta graduación para la medida aproximada del líquido que contiene. Se utiliza en volumetrías por la facilidad para ser agitado sin derramar líquido. También se emplea para recoger líquidos en montajes de destilaciones. |
 |
MATRAZ AFORADO
Es un recipiente en forma de pera, de fondo plano y cuello alto. Permite medir de forma exacta volúmenes de líquidos.
En la parte del cuello presenta una marca o enrase, que indica la altura que debe alcanzar el líquido para que el matraz contenga la capacidad que indica. Los de uso más frecuente son de 50, 100, 250, 500 y 1000 ml.
Se utiliza para preparar disoluciones de concentración conocida y en la disolución de muestras en un volumen determinado. |
 |
KITASATO
Es un recipiente semejante al matraz erlenmeyer con una salida lateral
próxima al cuello.
Se emplea para filtraciones por succión, previa conexión a un sistema de vacío (trompa de agua). También se
puede emplear para reacciones con producción de gases. |
 |
EMBUDO
Es un aparato de forma cónica que tiene en el extremo una prolongación tubular para facilitar el trasvase de líquidos o disoluciones de un matraz a otro. También se emplea para filtar por gravedad colocándole un cono de papel de filtro. |
 |
PAPEL DE FILTRO
Material necesario para las filtraciones, los hay de diferente poro. |
 |
PROBETA
Es un tubo de vidrio con base. Presenta graduación y se emplea para medidas de volúmenes. Las capacidades más frecuentes son. 10, 25, 50, 100, 500 y 1000 ml |
 |
ESPÁTULA
Permite coger pequeñas cantidades de productos sólidos. Pueden disponer de una cucharilla en el extremo. |
 |
CUENTAGOTAS O PIPETA PASTEUR
Consiste en un tubo con un estrechamiento en su parte inferior y en su extremo superior lleva una pera de goma para succionar el líquido y
verterlo posteriormente.
Se utiliza para añadir líquidos gota a gota. Es un instrumento de medida aproximada, ya que el volumen de las gotas depende de la naturaleza del líquido. |
 |
NUEZ
Sirve para sujetar una pinza a un soporte con barra. |
 |
PINZA
Sirve para sujetar los aparatos de un montaje. |
 |
SOPORTE CON BARRA
Se emplean para construir los diferentes montajes. Junto con las nueces y pinzas sujetaremos todos los aparatos del montaje. |
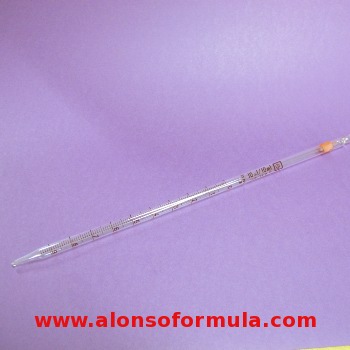 |
PIPETA GRADUADA
Es un tubo de vidrio de sección uniforme, con un estrechamiento en su parte inferior. Presentan una graduación, o escala de divisiones, en 1,0 ml, 0,1 ml o 0,01 ml dependiendo de la capacidad de la pipeta. Sus capacidades más frecuentes son: 5, 10, 25 y 50 ml. |
 |
ASPIRADOR
Aparato que se usa con la pipeta, actúa aspirando aire y llena la
pipeta de líquido, con una rueda facilita el enrase y un orificio que
al liberarlo facilita el trasvase del contenido. |
 |
TERMÓMETRO DE MERCURIO
Aparato para la medida de temperaturas. La toxicidad del mercurio
hace que hoy estén siendo sustituidos por los electrónicos. |
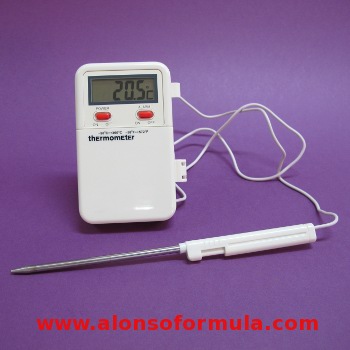 |
TERMÓMETRO ELECTRÓNICO
Se usan cada vez más en el laboratorio. Pero como cualquier aparato
electrónico debe ser adecuadamente calibrado. |
 |
VARILLA DE VIDRIO
Aparato utilizado para agitar líquidos y facilitar la disolución de
sólidos. |
 |
FRASCO LAVADOR
Permite disponer de agua destilada en la preparación de disoluciones. Ayuda a arrastrar el soluto que queda adherido a las paredes de los recipientes. |
 |
TUBO DE ENSAYO
Es un recipiente de forma cilíndrica y fondo redondo. Se utiliza para realizar ensayos o pruebas cualitativas de reacciones con pequeñas cantidades. |
 |
GAFAS DE PROTECCIÓN
Gafas de plástico que protegen al operario de salpicaduras que de
alcanzar los ojos pueden ser muy peligrosas. |
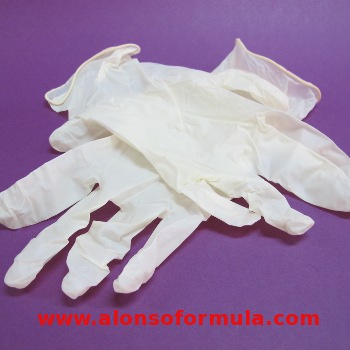 |
GUANTES DE PROTECCIÓN
Guantes que protegen del contacto con productos corrosivos y nocivos
para la piel. |
 |
MECHERO BUNSEN
Mechero de butano. Aporta una fuente puntual de calor para
calentamiento de líquidos, realización de reacciones y trabajo con
tubo de vidrio. |
 |
BALANZA ELECTRÓNICA
Balanza de uso común en el laboratorio por la facilidad de manejo.
Permite la tara del recipiente que usamos para pesar. |
 |
FRASCOS Y ETIQUETAS
Las disoluciones las guardamos en frascos y las etiquetamos para
mejor uso de las mismas. |
 |
HORNILLO ELÉCTRICO
Fuente de calor para calentamiento de líquidos con ayuda de
recipientes como vasos de precipitados. |
EJERCICIO 1
EJERCICIO 2
EJERCICIO 3
EJERCICIO 4
|
|

|
|
ETIQUETADOS
DE PRODUCTOS: PICTOGRAMAS |
|
Muchos productos del mercado son o pueden ser peligrosos para
las personas o el medio ambiente. La Unión Europea propone el uso de
pictogramas, imágenes que se incluyen en el etiquetado, para alertar de
esa peligrosidad. Los pictogramas actuales tienen forma de rombo rojo con
fondo blanco y un dibujo esquemático que alerta de diferentes peligros,
como puedes ver en el siguiente cuadro:
|
PICTOGRAMAS |
| Pictograma |
Símbolo |
Significado |
Precauciones |
Ejemplos |
| Nocivo
para la salud 
|
Signo de exclamación |
Puede irritar las vías respiratorias
Puede provocar somnolencia o vértigo
Puede provocar una reacción alérgica en la piel
Provoca irritación ocular grave
|
Evitar la respiración del producto y usar el producto en lugares ventilados y protegerse con guantes del contacto directo.
En caso de contacto con la piel: lavar con agua y jabón abundantes.
En caso de contacto con los ojos: aclarar cuidadosamente con agua durante varios minutos.
En caso de ingestión: llamar a un CENTRO de información toxicológica o a un médico en caso de malestar. |
Detergentes para lavadoras,
limpiadores de inodoros,
líquidos refrigerantes,
amoníaco,
lejía |
| Peligro para el medio ambiente

|
Medio ambiente |
Muy tóxico para los organismos acuáticos, con efectos nocivos duraderos.
|
Evitar su liberación al medio ambiente.
Desechar estos productos en un punto limpio o en contenedores adecuados. |
Plaguicidas,
biocidas,
gasolina,
benceno,
cianuro de potasio |
| Inflamable

|
Llama |
Gas/Aerosol/Líquido/Sólido extremadamente inflamable
o inflamable |
Utilizar en lugares bien ventilados.
Evitar fuentes de calor cuando se usen o almacenen.
No pulverizar sobre una llama abierta.
Mantener el recipiente cerrado herméticamente.
Mantener en lugar fresco.
Proteger de la luz del sol. |
Hidrógeno,
etino,
éter etílico,
etanol,
acetona,
gasolina,
butano,
gas natural |
| Comburente

|
Llama sobre un círculo |
Puede provocar o agravar un incendio o una explosión;
comburente o muy comburente. |
Mantener alejado de fuentes de calor, chispas.
No almacenar ni usar en contacto con productos inflamables.
Usar con guantes/prendas/gafas/máscara de protección. |
Oxígeno,
nitrato de potasio,
peróxido de hidrógeno o agua oxigenada. |
| Corrosivo
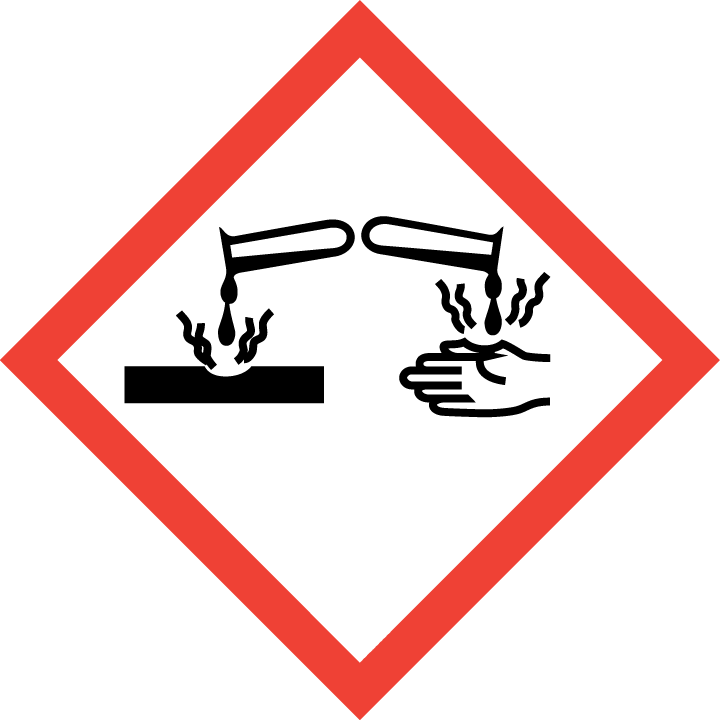
|
Corrosión |
Provoca quemaduras graves en la piel y lesiones oculares graves |
Usar con elementos protectores como guantes, gafas y mascarillas.
Lavarse concienzudamente tras la manipulación.
Conservar únicamente en el recipiente original. |
Desatascadores de tuberías,
ácido acético,
ácido clorhídrico,
hidróxido de sodio,
amoníaco |
| Explosivo

|
Bomba explotando |
Explosivo. |
Evitar golpes.
Llevar guantes/prendas/gafas/máscara de protección.
Solicitar instrucciones especiales antes del uso.
Mantener alejado de fuentes de calor, chispas, llama abierta o superficies calientes.
No fumar. |
Fuegos artificiales,
productos pirotécnicos,
munición |
| Gas a presión

|
Bombona de gas |
Contiene gas a presión. |
Proteger de la luz del Sol.
Puede provocar quemaduras o lesiones criogénicas.
Llevar guantes/gafas/máscara que aíslen del frío.
No someter a altas temperaturas, o acercarlas a fuentes de calor. |
Botellas de gas a presión,
insecticidas caseros,
ambientadores caseros |
| Peligro grave para la salud

|
Peligro para la salud |
Puede ser mortal en caso de ingestión y penetración en las vías respiratorias
Perjudica a determinados órganos
Puede provocar cáncer |
En caso de ingestión: llamar inmediatamente a un CENTRO de información toxicológica o a un médico.
Usar mascarillas y guantes en su manipulación.
Lavarse concienzudamente tras la manipulación.. |
Metanol,
monóxido de carbono,
cloro,
trementina,
gasolina |
| Extremadamente tóxico

|
Calavera y tibias cruzadas |
Mortal en caso de ingestión
Mortal en caso de inhalación
Tóxico en caso de ingestión
Tóxico por inhalación |
Lavarse concienzudamente tras la manipulación.
En caso de ingestión: llamar inmediatamente a un CENTRO de información toxicológica o a un médico.
En caso de contacto con la piel: lavar suavemente con agua y jabón abundantes.
Usar medidas de seguridad adecuadas, gafas, guantes, máscaras de gas. |
Plaguicidas,
biocidas,
metanol,
cianuro,
trióxido de arsénico |
| Recuerda que ningún producto con
pictogramas de seguridad debe estar al alcance de los niños ni de
personas vulnerables. |
EJERCICIO 5
EJERCICIO 6

|
|
PROPIEDADES
GENERALES Y CARACTERÍSTICAS DE LA MATERIA |
|
Ya vimos que las magnitudes físicas son propiedades que
podemos medir o cuantificar. Estas propiedades pueden ser generales o
características de la materia. En general las magnitudes miden
propiedades generales de la materia, es decir, propiedades que pueden
tener un valor cualquiera en una sustancia, por ejemplo: la masa, el
volumen, la temperatura o la presión. Si un trozo de metal tiene una masa
u otra nos indica lo grande o pequeño que pueda ser pero no nos da
información de qué metal pueda ser. Serían útiles magnitudes que nos
pudieran dar información de qué sustancia es, eso pasa con las
propiedades características. Las propiedades características las medimos
con magnitudes como: la densidad, el calor específico o la resistividad.
Si tenemos una sustancia pura, es decir que no sea mezcla de otras
sustancias, estas propiedades características nos pueden informar de que
sustancia se trata. Por ejemplo podemos calcular la densidad de diferentes
metales para poder caracterizarlos. Si la densidad calculada coincide con
la de un metal determinado, probablemente se trate de ese metal, pero si
no coincide sabemos seguro que no se trata de ese metal.

|
|
CÁLCULO
DE LA DENSIDAD |
|
¿Qué es la densidad y cómo calcular la densidad de una sustancia?
Los cuerpos, por el hecho de tener materia, tienen masa
y volumen. Un mismo cuerpo sólido o líquido, ya veremos que los gasas
son algo diferentes, si tienen más masa tienen más volumen, y estas
cantidades son proporcionales, si tiene el doble de masa tendrá el doble
de volumen.
La densidad es la magnitud que mide esta relación entre
masa y volumen, es por tanto una magnitud derivada. La densidad es el
cociente entre la masa de un cuerpo y el volumen que ocupa.

La densidad es una magnitud característica de la sustancia. Una
magnitud característica es muy interesante pues nos puede indicar de que
sustancia se trata. Un líquido transparente con una densidad de 1g/cm3
puede ser agua, pero si su densidad es 0,8 g/cm3 ya sabemos
seguro que no es agua.
La historia de Arquímedes y la corona de oro.
Vamos a utilizar esta simulación de la Universidad de Colorado para
realizar cálculos de densidades
En INTRODUCCIÓN: Puedes calcular la densidad de distintos
materiales. Observa que se hunden más o menos en la cubeta de agua según
la densidad que tengan.
En COMPARAR:
Observa el comportamiento de cuerpos de misma masa, de mismo volumen
y de misma densidad frente al agua. ¿De qué depende que floten más o
menos? En MISTERIO: Calcula la densidad de los cuerpos problema y
averigua de qué material puede tratarse con la tabla de densidades.
EJERCICIOS
PARA PRACTICAR
 |
|
DETERMINACIÓN
EXPERIMENTAL
DE LA DENSIDAD |
- Determinación de la densidad de un líquido puro. Agua
Para determinar experimentalmente la densidad de un líquido puro, como agua,
debemos medir una masa de cierta cantidad de agua, y luego medir su volumen.
Para medir la masa usaremos la balanza de laboratorio, el recipiente puede
ser una probeta, que también nos servirá para medir su volumen.
 |
 |
 |
| Colocamos la probeta en la balanza y taramos, para restar la
masa de la probeta |
Echamos una cierta cantidad de agua en la probeta, medimos la
masa con la balanza. |
Y medimos el volumen con la probeta. Luego calculamos la
densidad. |
Recuerda anotar los valores y las unidades. Luego usarás estos datos para
calcular la densidad.
- Determinación de la densidad de una disolución. Sal en agua
Una disolución de sal en agua es líquida, así que procederemos igual que en
el apartado anterior. La diferencia es que en un líquido puro siempre vamos a
obtener la misma densidad, pero en una disolución el valor de la densidad
dependerá de su concentración, es decir, de la proporción de sal en agua.
 |
 |
 |
| Colocamos la probeta en la balanza y taramos, para restar la
masa de la probeta |
Echamos una cierta cantidad de agua salada en la probeta,
medimos la masa con la balanza. |
Y medimos el volumen con la probeta. Luego calculamos la
densidad. |
- Determinación de la densidad de un sólido de forma prismática o
esférica.
Si el sólido tiene una forma simple, como un prisma cuadrangular o una
esfera, podemos determinar su volumen midiendo sus dimensiones con una regla o
con un calibre, si queremos ser más precisos.
Medir con un calibre:
Si la forma es un prisma cuadrangular, medimos sus tres dimensiones para
calcular el volumen: V = a · b · c
 |
 |
 |
| Medimos la base del prisma con el calibre. |
Medimos la altura del prisma con el calibre. Con los datos
calculamos el volumen. |
Medimos la masa con la balanza. Luego calculamos la densidad. |
Si la forma es una esfera medimos el diámetro, para calcular el radio, y con
este calcular el volumen de la esfera: V = 4/3 π r3
Después de medir su masa en la balanza calculamos la densidad.
- Determinación de la densidad de una piedra por inmersión en agua.
Cuando tenemos un cuerpo de forma irregular como una piedra es más complicado
medir el volumen.
Si el cuerpo es pequeño y cabe en la probeta, introducimos una cierta
cantidad de agua en la probeta y la medimos, luego sumergimos el cuerpo con
cuidado y medimos el volumen que alcanza el agua, la diferencia de estos dos
volúmenes nos da el volumen del cuerpo.
Si el cuerpo es grande, y no cabe en la probeta, usamos un vaso de plástico
en el que quepa, lo introducimos lleno de agua en otro recipiente, al introducir
el cuerpo en el vaso el agua se derrama quedando en el recipiente exterior.
Ahora ya podemos medir este volumen de agua en una probeta, será igual al
volumen del cuerpo.
 |
 |
| Con la balanza medimos la masa de la piedra. |
Llenamos un vaso de agua dentro de un cristalizador. |
 |
 |
| Introducimos la piedra en el vaso, se derramará un volumen de
agua igual al volumen de la piedra. |
Echamos el agua derramada en la probeta y determinamos su
volumen. Con los datos de masa y volumen calculamos la densidad. |
Para medir la masa usamos como siempre la balanza. Finalmente calculamos la
densidad.
Los densímetros son aparatos de laboratorio diseñados para medir la
densidad de diferentes líquidos. Los podemos usar para medir la densidad
de líquidos puros o de disoluciones.
Parece ser que fue
Hipatia
de Alejandría su inventora.
Los densímetros están fabricados de vidrio dentro del cual hay un
contrapeso calibrado para que al introducirlo en un líquido, por el
principio de Arquímedes, sobresalga una escala donde podemos leer la
densidad del líquido.
Hay densímetros específicos para algunas disoluciones, por ejemplo el
alcoholímetro o alcohómetro: para medir el porcentaje de alcohol de una bebida
alcohólica, el sacarímetro: para medir la cantidad de azúcar de una
melaza, o el lactómetro: para medir la densidad y calidad de la leche.
Te dejo este vídeo para que veas algunos tipos y como se usan:

|
        |
|
