Observa este interesante vídeo sobre los polímeros:
Los polímeros son macromoléculas formadas por unión, mediante enlaces covalentes, de unidades simples llamadas
monómeros. Los polímeros tienen elevada masa molecular de por lo menos miles
o millones de unidades de masa atómica.
Las proteínas, el ADN y ARN, el almidón, la
celulosa, la seda, el caucho son ejemplos de polímeros naturales, y el
celuloide, la baquelita, el nailon, el poliéster y el
polietileno de polímeros sintéticos.
Los primeros polímeros sintéticos se obtuvieron por modificación de polímeros naturales. En 1839
Charles Goodyear realiza el vulcanizado del caucho. En 1870, John W. Hyatt sintetizó el celuloide a partir de nitrato de celulosa.
El primer polímero totalmente sintético se obtuvo en 1909, cuando el químico belga
Leo Hendrik Baekeland fabrica la baquelita a partir de formaldehído y fenol. El poliestireno (PS) se sintetiza en 1911 y el poli(cloruro de vinilo) (PVC) en 1912.
En 1922, el químico alemán Hermann Staudinger comienza el estudio de los polímeros y en 1926 expone su hipótesis de que se trata de largas cadenas de unidades pequeñas unidas por enlaces covalentes. Propuso las fórmulas estructurales del poliestireno y del polioximetileno, tal como las conocemos actualmente, como cadenas moleculares gigantes, formadas por la asociación mediante enlace covalente de ciertos grupos atómicos llamados "unidades estructurales". Este concepto se convirtió en "fundamento" de la química macromolecular sólo a partir de 1930, cuando fue aceptado ampliamente. En 1953 recibió el Premio Nobel de Química por su trabajo.
Wallace Carothers, trabajando en la empresa DuPont desde 1928, desarrolló un gran número de nuevos polímeros: poliésteres, poliamidas, neopreno, etc.
La Segunda Guerra Mundial contribuyó al avance en la investigación de polímeros. Por ejemplo, fue muy importante la sustitución del caucho natural por caucho sintético.
- Clasificación de los polímeros según su composición:
HOMOPOLÍMEROS
Están formados por repetición de un único tipo de monómero. Ejemplo: polietileno (PE)
COPOLÍMEROS
Están formados por dos o más tipos de monómeros. Ejemplo: poliamida (PA)
- Clasificación de los polímeros según su estructura:
LINEALES
Están formados por monómeros que se unen dando cadenas lineales. Ejemplo: poliestireno (PS)
RAMIFICADOS
Están formados por monómeros que se unen dando estructuras ramificadas tridimensionales debido a que presentan monómeros trifuncionales o
polifuncionales.
- Clasificación de los polímeros según su comportamiento térmico:
TERMOPLÁSTICOS
Son polímeros que por calentamiento se vuelven deformables, adquieren plasticidad. Se pueden moldear por la acción del calor pero se vuelven rígidos al enfriarse. Este proceso puede repetirse, en principio, indefinidamente.
Poseen una estructura molecular de cadenas abierta o hilos. Puntos de fusión bajos. Solubles en disolventes orgánicos. Reciclables.
TERMOESTABLES
Son polímeros que una vez formados no se pueden moldear o fundir por la acción del calor. Se obtienen por condensación. Se moldean antes de que la reacción llegue a su fin.
Presentan estructura entrecruzada. En general insolubles en disolventes orgánicos. Se descomponen a elevada temperatura. Presentan estructuras rígidas debido al gran entrecruzamiento molecular.
ELASTÓMEROS
Son polímeros que presentan propiedades elásticas. Se pueden estirar sin que se rompan y recuperar la forma original. Presentan estructuras tridimensionales debilmente entrecruzadas. Presentan semejanzas con el caucho natural. No son termoconformables.
- Clasificación de los polímeros según su método de obtención:
POLÍMEROS DE ADICIÓN
Son polímeros formados por la unión de moléculas insaturadas, que rompen su enlace múltiple sin eliminación de moléculas pequeñas.
POLÍMEROS DE CONDENSACIÓN
Son polímeros formados por la unión de dos monómeros difuncionales o polifuncionales, que reaccionan entre sí eliminando moléculas de pequeño tamaño aparte del polímero.
- Reacciones de polimerización:
Reacción de polimerización por adición: Los polímeros de adición están formados por la unión de moléculas sencillas insaturadas, en los que se rompen los enlaces múltiples sin eliminación de moléculas pequeñas. Es una reacción en cadena que transcurre en tres etapas: iniciación, propagación y terminación. El mecanismo puede ser por radicales libre o por
iones.
Veamos el mecanismo de adición por radicales libres:
Iniciación:
Los iniciadores de la polimerización pueden ser peróxidos
orgánicos que se descomponen produciendo radicales libres.
Propagación:
El radical libre ataca el doble enlace del monómero, generando un
nuevo radical libre que reacciona con nuevas moléculas de monómero,
incrementando la cadena del polímero.
Terminación:
Se puede producir por combinación de dos radicales libres:
También se puede producir por desproporción al transferirse un
átomo de hidrógeno de un radical a otro:
Reacción de polimerización por condensación: La
condensación se produce por reacción, de dos monómeros distintos, en
la que se genera alguna molécula pequeña también.
Por ejemplo el PET o polietilentereftalato es un poliéster que se
forma por condensación del etanodiol y el ácido 1,4-bencenodicarboxílico:
|
POLÍMEROS DE ADICIÓN |
| POLÍMERO
Nombre tradicional
Abreviatura |
NOMBRE
IUPAC |
MONÓMERO |
ESTRUCTURA |
| Polietileno PE |
Polieteno |
Eteno o etileno |
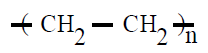 |
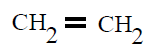 |
| Polipropileno PP |
Polipropeno |
propeno o propileno |
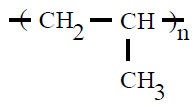 |
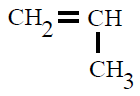 |
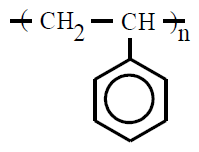
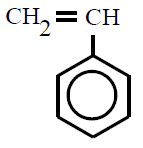
| Poliestireno PS |
Poli(etenilbenceno) |
etenilbenceno, vinilbenceno o
estireno |
 |
 |
| Poli(cloruro de vinilo) PVC |
Poli(cloruro de vinilo) |
cloroeteno o cloruro de
vinilo |
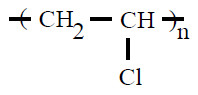 |
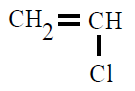 |
| Poliacrilonitrilo PAN |
Poliacrilonitrilo |
propenonitrilo o
acrilonitrilo |
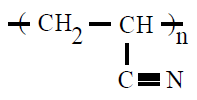 |
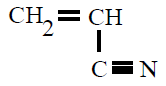 |
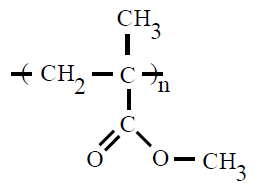
| Poli(metacrilato de metilo) PMMA |
Poli(metacrilato de metilo) |
2-metilpropenoato de metilo o
metacrilato de metilo |
 |
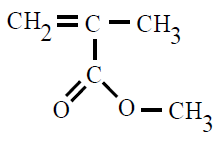 |
| cis 1,4-polibutadieno PB |
Polibutadieno |
1,3 butadieno |
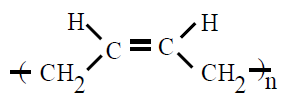 |
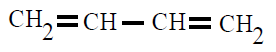 |
CAUCHO:
El caucho es un polímero elástico, cis-1,4-polisopreno, polímero del isopreno o
2-metil-1,3-butadieno. Se obtiene como una emulsión lechosa (conocida como látex)
de la savia de varias plantas, como la Hevea brasiliensis. Otra planta que contiene látex
es el diente de león común.
El caucho fue recolectado durante mucho tiempo ya antes de la llegada de los europeos, ciertos indígenas del amazonas lo llamaban cautchouc, o "árbol que llora", y lo usaron para hacer vasijas.
En 1839, por accidente, un inventor de Boston, Charles Goodyear dejó caer una mezcla de caucho y de azufre sobre una estufa caliente. Fue el principio de la vulcanización, el proceso que hizo el caucho más resistente convirtiéndolo en producto esencial de la era industrial.
Actualmente se fabrican multitud de artículos de caucho para diferentes usos. El caucho es ampliamente utilizado en la fabricación de neumáticos, artículos impermeables y aislantes, por sus excelentes propiedades de elasticidad y resistencia ante los ácidos y las sustancias alcalinas. Es repelente al agua, aislante de la temperatura y de la electricidad.
POLIETILENO (PE):
El polietileno (PE) es químicamente el polímero más simple. Es uno de los plásticos más comunes debido a su bajo precio y simplicidad en su fabricación. Es químicamente inerte. Se obtiene de la polimerización del eteno o etileno
CH2=CH2 , del que deriva su nombre.
El 27 de marzo de 1933, en Inglaterra, fue sintetizado tal como lo conocemos hoy en día, por Reginald Gibson y Eric Fawcett. Aplicando muy altas presiones y una temperatura de 170 °C en un autoclave, obtuvieron el material de alta viscosidad y color blanquecino que se conoce hoy en día como "polietileno de baja densidad"
(LDPE).
La altísima presión requerida era un inconveniente económico. Por ello varios investigadores comenzaron a buscar catalizadores que permitiesen la polimerización a presión más reducida. Esto dio origen a los catalizadores
Ziegler-Natta, por los cuales Karl Ziegler y Giulio Natta recibieron el premio Nobel de química en 1963.
Los catalizadores clásicos del tipo Ziegler-Natta son catalizadores mixtos que contienen un compuesto organometálico de los grupos principales I, II o III del sistema periódico, por ejemplo trietilaluminio
Al(C2H5)3, y un compuesto de un metal de transición, por ejemplo tetracloruro de titanio
TlCl4.
El polietileno de baja densidad LDPE es un polímero con una estructura de cadenas muy ramificadas; esto hace que tenga una densidad más baja que la del
HDPE (0,91-0,94 g/cm3).
Usos: Sacos y bolsas plásticas. Cubiertas para invernaderos y otros usos agrícolas.
Juguetes. Objetos de menaje, como vasos, platos, cubiertos. Botellas.
Tubos y tuberías.
El polietileno de alta densidad (HDPE) es un polímero que se caracteriza por:
excelente resistencia térmica y química, muy buena resistencia al
impacto, es flexible, aun a bajas temperaturas, es más rígido que el polietileno de baja
densidad, es muy ligero y su densidad se encuentra en el entorno de 0,94-0,97
g/cm3.
Usos: Tuberías para distribución de agua potable. Envases de alimentos, detergentes, y otros productos químicos. Artículos para el hogar. Juguetes. Dispositivos protectores (cascos, rodilleras, coderas...).
POLICLORURO DE VINILO (PVC):
Es un termoplástico que se obtiene por polimerización del cloruro de vinilo, o cloroeteno. La resina que resulta de esta polimerización es la más versátil de la familia de los plásticos ya que a partir de ella se pueden obtener productos rígidos y flexibles.
Es un plástico utilizado en áreas tan diversas como la construcción, energía, salud, preservación de alimentos y artículos de uso diario, entre otros.
El policloruro de vinilo fue descubierto por accidente por lo menos en dos ocasiones durante el siglo XIX: en 1835, por primera vez, por Henri Victor Regnault, y en 1872 por Eugen
Baumann.
En 1926, Waldo Semon, en colaboración con la B. F. Goodrich Company, desarrolló un método de plastificación del PVC mediante la mezcla con aditivos que ayudó a que el material fuese más flexible y más fácil de fabricar.
Tiene una elevada resistencia a la abrasión, junto con una baja densidad (1,4
g/cm3), buena resistencia mecánica y al impacto, lo que lo hace común e ideal para la edificación y construcción.
Es un material altamente resistente, los productos de PVC pueden durar hasta más de sesenta años como se comprueba en aplicaciones tales como tuberías para conducción de agua potable y sanitarios; de acuerdo al estado de las instalaciones se espera una prolongada duración del PVC así como ocurre con los marcos de puertas y ventanas.
Debido a los átomos de cloro que forman parte del polímero PVC, no se quema con facilidad ni arde por sí solo y cesa de arder una vez que la fuente de calor se ha retirado.
Se emplea eficazmente para aislar y proteger cables eléctricos en el hogar, oficinas y en las industrias debido a que es un buen aislante eléctrico.
Se vuelve flexible y moldeable sin necesidad de someterlo a altas temperaturas (basta unos segundos expuesto a una llama) y mantiene la forma dada y propiedades una vez enfriado a temperatura ambiente, lo cual facilita su modificación.
Existe un debate acerca de la toxicidad del PVC. Mientras que la industria del PVC niega sus posibles efectos tóxicos sobre la salud y el medio ambiente, ciertos colectivos y organizaciones ecologistas denuncian que la inhalación prolongada de cloruro de vinilo podría ser la causa de dolencias en el hígado y cáncer.
POLIESTIRENO (PS):
El poliestireno (PS) es un polímero termoplástico que se obtiene de la polimerización del
estireno, o etenilbenceno.
Existen cuatro tipos principales: el PS cristal o GPPS (del inglés: General Purpose Polystyrene), que es transparente, rígido y quebradizo; el poliestireno de alto impacto o HIPS (del inglés: High Impact Polystyrene), resistente al impacto y opaco blanquecino; el poliestireno expandido o EPS (del inglés: Expandable Polystyrene; PSE en francés), muy ligero; y el poliestireno
extruído, similar al expandido pero más denso e impermeable.
Las aplicaciones principales del PS de alto impacto y el PS cristal son la fabricación de envases mediante extrusión-termoformado, y de objetos diversos mediante moldeo por inyección.
Las formas expandida y extruída se emplean principalmente como aislantes térmicos en construcción y para formar embalajes de objetos frágiles. El EPS también es utilizado para la producción de cajas de pescado o neveras para el transporte de vacunas, por su capacidad aislante.
La primera producción industrial de poliestireno cristal fue realizada por BASF, en Alemania, en 1930. El PS expandido y el PS de alto impacto fueron inventados en las décadas siguientes. Desde entonces los procesos de producción han mejorado sustancialmente y el poliestireno ha dado lugar a una industria sólidamente establecida.
El poliestireno es hoy el cuarto plástico más consumido, por detrás del polietileno, el polipropileno y el PVC.
El poliestireno de alto impacto se utiliza principalmente en la fabricación de objetos mediante moldeo por inyección. Algunos ejemplos: carcasas de televisores, impresoras, puertas e interiores de frigoríficos, maquinillas de afeitar desechables, juguetes. Según las aplicaciones se le pueden añadir aditivos como por ejemplo sustancias ignífugas o colorantes.
El poliestireno cristal se utiliza también en moldeo por inyección allí donde la transparencia y el bajo coste son importantes. Ejemplos: cajas de CD, perchas,
hueveras. Otra aplicación muy importante es en la producción de espumas rígidas, denominadas a veces "poliestireno extruido" o XPS, a no confundir con el poliestireno expandido EPS. Estas espumas XPS se utilizan por ejemplo para las bandejas de carne de los supermercados, así como en la construcción.
La forma expandida (poliestireno expandido) EPS, se utiliza como aislante térmico y acústico y es ampliamente conocido bajo diversas marcas comerciales (Poliexpan, Telgopor, Emmedue, Icopor, etc.).
La forma extruída (poliestireno extruido) XPS, se emplea como aislamiento térmico en suelos, debido a su mayor resistencia mecánica, y también como alma en paneles sandwich de fachada. Pero su uso más específico es el de aislante térmico en cubiertas invertidas, donde el aislamiento térmico se coloca encima del impermeabilizante, protegiéndolo de las inclemencias del tiempo y alargando su vida útil.
Los materiales plásticos que podemos encontrar a la venta presentan unos símbolos que nos anuncian el tipo de plástico de que se trata y la posibilidad de ser reciclado. En este caso, el símbolo de reciclado está formado por un triángulo de tres flechas que
contienen un número y unas letras que señalan el tipo de material. Podemos encontrarnos en el mercado los siguientes símbolos:
Estos son algunos ejemplos de plásticos que podemos
encontrar por casa o cuando vamos al súper.
PET o PETE (Polietileno tereftalato) 1. Es uno de los plásticos más comunes,
es ligero, no es caro y es fácilmente reciclable, usado sobre todo para envasar alimentos y bebidas. La mayoría de las botellas de agua que se comercializan en España están hechas a partir de PET. Una vez reciclado, se puede utilizar, por ejemplo, en la elaboración de fibras textiles y piezas de automóvil.
 |
 |
| Botella de agua mineral |
Bote de mayonesa |
 |
 |
| Botella de aceite |
Envase de lavavajillas |
HDPE (Polietileno de alta densidad) 2. Gracias a su versatilidad y resistencia química se utiliza, sobre todo, en envases, en productos de limpieza de hogar o químicos industriales, como botellas de champú, detergente, cloro, etc.
Se recicla de muy diversas formas, como en tubos, botellas de detergentes y limpiadores, muebles de jardín, etc.
 |
 |
| Bolsa de supermercado |
Bolsa de supermercado |
 |
 |
| Bote de champú |
Bote de gel de baño |
 |
 |
| Envase de limpiador vitrocerámicas |
Envase de detergente |
V o PVC (Vinílicos o Cloruro de Polivinilo) 3. Es muy
resistente. No se usa para alimentos, sino para la fabricación de productos de alta resistencia como ventanas o materiales para construcción. Una vez reciclado, puede servir para la fabricación de paneles, tarimas, tapetes, etc.. El PVC puede soltar diversas toxinas (no hay que quemarlo ni dejar que toque
alimentos).
PEBD (Polietileno de baja densidad) 4. Este plástico fuerte, flexible y transparente se puede encontrar en algunas botellas y bolsas muy diversas (de la compra o para comida congelada, pan, etc.), algunos muebles y alfombras, entre otros. Tras su reciclado, se puede utilizar de nuevo en contenedores y papeleras, sobres, paneles, tuberías o baldosas.
 |
 |
|
Envase de rollos de cocina
|
Envase de rollos de papel higiénico
|
PP (Polipropileno) 5. Su alto punto de fusión permite envases capaces de contener líquidos y alimentos calientes. Se utiliza en la fabricación de envases médicos, yogures, pajitas, botes de ketchup, tapas, algunos contenedores de cocina, etc. Al reciclarse se pueden obtener señales luminosas, cables de batería, escobas, cepillos,
rastrillos, cubos, bandejas, etc.
 |
 |
| Envase de pasta |
Envase de pañuelos de papel |
 |
 |
| Tarrina de CDs |
Tarrina de CDs |
 |
 |
| Fiambrera |
Envase de detergente |
PS (Poliestireno) 6. Utilizado en platos y vasos de usar y tirar, hueveras, bandejas de
carne, etc. Su bajo punto de fusión hace posible que pueda derretirse en contacto con el calor.
Tras su reciclaje, se pueden obtener diversos productos como material para edificación, aislantes, etc.
 |
 |
| Tarrina de CDs |
Caja de bombones |
 |
 |
| Bandeja de supermercado |
Envase de palillos |
Otros plásticos 7. En este cajón de sastre se incluyen una gran diversidad de plásticos muy difíciles de
reciclar, como el policarbonato, y que sirven para elaborar DVD´s, gafas de sol, MP3 o
PC´s.
 |
 |
| Bolsa de pistachos |
Envase de toallitas húmedas |
 |
 |
Jarra filtradora de agua
SMMA - Estireno metilmetacrilato
SAN - Estireno acrilonitrilo |
Jarra filtradora de agua
ASA - Acrilonitrilo estireno acrilato
ABS - Acrilonitrilo butadieno estireno |
Como variantes de estos símbolos de materiales plásticos se pueden encontrar solo con los números, sin los acrónimos, o con el anillo más grueso de
Moebius y, en su interior, el número que corresponda. Si el acrónimo lleva una "R" delante, significa que el producto contiene materiales plásticos reciclados. Por su parte, si el símbolo lleva el acrónimo ABS, se refiere al acrilonitrilo butadieno estireno, un plástico muy duro utilizado en automoción y en usos tanto industriales como domésticos.
EJERCICIOS
PARA PRACTICAR
Una visión crítica sobre el abuso de los plásticos, por Annie
Leonard:
Está claro que no todo el plástico se recicla. Gran
parte de los plásticos que usamos va a parar al océano. Pero el mar no
los destruye. Esta enorme cantidad de plástico en pequeños fragmento
está poniendo en peligro los ecosistemas marinos.

|
