  
|
|
|
|
ENLACE
QUÍMICO |
|
No tema anterior empezamos a coñecer mellor aos átomos. Vimos como son, de que partículas compóñense e como se distribúen os electróns no interior do átomo. Neste tema intentaremos dar resposta a por que os átomos case nunca aparecen illados na natureza, aparecen agrupados en pequenos grupos que chamamos
moléculas ou en grupos inmensos que chamamos redes cristalinas. Entender como se agrupan os átomos axúdanos a entender mellor as súas propiedades como substancias.
A razón que fai que os átomos se unan é a razón que move todos os cambios da natureza, os átomos únense para conseguir máis estabilidade. A maior parte dos átomos son máis estables xuntos que separados. Intentaremos comprender por que.
Por exemplo, o osíxeno e o hidrógeno nunca aparecen na natureza como átomos illados, atopámolos formando as moléculas gaseosas,
O2 e H2 ou para nós os seres vivos a imprescindible molécula de auga,
H2O. A maior parte dos elementos da Táboa Periódica son metais, ben pois os metais sempre aparecen formando parte de sales ou de redes cristalinas metálicas. O carbono outro querido elemento para os seres vivos tampouco aparece illado, aparece en innumerables moléculas orgánicas, en sales como os carbonatos, en gases como o
CO2, e unido consigo mesmo formando redes covalentes no grafito e o diamante.
Imaxina dous átomos a gran distancia. Se son máis estables unidos que separados cando se acheguen é porque as forzas de atracción serán favorables para a formación do enlace. Cales poden ser estas forzas? pois as interaccións dos electróns dun átomo cos protones do outro e viceversa. Pero a medida que se acheguen tamén estarán sometidos a forzas de repulsión, as establecidas entre os electróns dun átomo e os do outro, ou as interaccións entre os núcleos dos dous átomos. Chegará un momento en que as forzas atractivas se maximizan e as repulsivas
se minimizan, neste momento os núcleos estarán a unha distancia que chamaremos distancia de enlace. Xa non se poden xuntar máis pois se repelerían, nin se poden separar pois se atraerían. Diremos que quedaron enlazados.
SIMULACIÓN:
FORZAS ENTRE ÁTOMOS, en educaplus.org
Chamamos enlace químico á interacción que se dá entre os átomos cando se unen para dar moléculas ou redes cristalinas.
Para entender por que se estabilizan os átomos ao formar enlaces é útil fixarse nos únicos elementos da Táboa que non teñen tendencia a asociarse, son tan estables que non necesitan unirse a outros átomos. Son os gases nobres. Non foi fácil descubrilos pois existen en pequenas cantidades no aire. Houbo que licuar o aire para obtelos illados. Máis fantástica é a historia do helio,
He, que foi descuberto antes no Sol que na Terra.
Por que son tan estables os gases nobres? O único que diferencia aos gases nobres dos demais elementos, como xa vimos no tema anterior, é que teñen as capas electrónicas completas, con máis propiedade, teñen 8 electróns na capa máis externa, os dous electróns s, e os seis electróns p. Ter esta configuración
ns2 np6 debe de conferir gran estabilidade aos átomos. Esta configuración coñécese como configuración de gas
nobre.
Todos os demais átomos tenden a conseguir esta configuración de gas nobre cando se combinan con outro átomos. Este comportamento denominámolo
Regra do octeto: Os átomos cando se asocian con outros átomos tenden a gañar, perder ou compartir electróns para conseguir configuración de gas nobre.
Ben, xa vimos que para conseguir estabilidade os átomos deben conseguir configuración de gas nobre, e para conseguir esta configuración deben de gañar, perder ou compartir electróns. En función de como se comporten os átomos para conseguir configuración de gas nobre vannos a aparecer tres tipos de enlace: Enlace iónico, enlace covalente e enlace metálico.

|
|
ENLACE
IÓNICO |
|
Enlace iónico: dáse entre átomos ou grupos atómicos que teñen carga eléctrica e chamamos
ións . En compostos binarios, de dous elementos, dáse entre un metal e un non metal. O metal perde electróns para dar un
ión positivo, ou catión, e o non metal gaña electróns para dar un ión negativo ou anión. Os
catións ou anións tamén poden ser grupos de átomos como xa veremos. Os compostos iónicos forman redes cristalinas e son sólidos.
O enlace iónico fórmase cando ións de distintos signos únense por forzas electrostáticas para dar redes cristalinas.
Os ións poden ser monoatómicos ou poliatómicos. Os ións monoatómicos perden ou gañan electróns para obter configuración electrónica de gas nobre. Os
ións positivos chámanse catións e os ións negativos chámanse anións. Na rede cristalina cada ión dun signo rodéase de
ións de signo contrario para dar unha estrutura que maximiza as forzas atractivas fronte ás repulsivas.
En función da carga e tamaño dos ións estes ordénanse en distintos tipos de redes cristalinas. A que tes na imaxe é a rede do cloruro de sodio, NaCl. Cada ión Na+ rodéase de 6 iones
Cl-, e cada ións Cl- de 6 iones Na+ . Entre os
ións non hai contacto atráense por forzas electrostáticas de Coulomb. Na rede cristalina tamén hai forzas repulsivas entre
ións do mesmo signo, pero fíxate que estes están máis lonxe entre si que os de signo contrario. O balance entre as forzas atractivas e repulsivas na rede cristalina é o que se coñece como enerxía de rede.
Hai redes cristalinas con maior índice de coordinación, ou número de
ións que rodean a un ión de signo contrario. O a rede do CsCl, cada ión
Cl-, está rodeado por 8 ións Cs+ , e cada ión Cs+ está rodeado por 8
ións Cl-.
Cando os ións non teñen a mesma carga, en valor absoluto, non hai o mesmo número de
ións que rodean a outro de signo contrario. Por exemplo na fluorita, CaF2, cada
ión F- está rodeado de 4 ións Ca2+ , e cada ión Ca2+ está rodeado por 8
ións F-.
Como se forman os ións? fíxate na seguinte simulación:
SIMULACIÓN:
ENLACE IÓNICO en educaplus.org
Os ións positivos son metais, que teñen tendencia a perder electróns, pois así conseguen configuración de gas nobre. Tamén poden ser
ións positivos grupos atómicos como o ión amonio: NH4+ . Os
ións negativos son non metais, que teñen tendencia a gañar electróns para así conseguir configuración de gas nobre. Tamén poden ser
ións negativos grupos atómicos como o ión carbonato, CO32-, o
ión nitrato, NO3-, ou o ión sulfato, SO42-.
As sustancias iónicas son todas sólidas, pero con frecuencia
atopámonos con sustancias moi fráxiles, ao ser golpeadas rómpense con facilidade xa que ao desprazarse partes da rede cristalina pódense poñer en contacto
ións co mesmo signo que se repelen.
Cando as cargas dos ións sexan baixas e os ións voluminosos atopamos moitos sales que son solubles en auga. Pero tamén atopamos sales que son moi pouco solubles, cando as cargas dos
ións sexan altas e os tamaños dos ións pequenos. O NaCl de sodio que forma parte do auga do mar é moi soluble, en cambio o
CaCO3, que forma parte da roca caliza é prácticamente insoluble.
O proceso de disolución dos sales débese a que as interaccións dos
ións superficiais coas moléculas de auga, que son polares, son máis fortes que as interaccións dos
ións entre si. Os ións rodéanse de moléculas de auga, dicimos que están disoltos, e representámolos desta forma:
Na+(aq)
|
PROPIEDADES DAS
SUSTANCIAS IÓNICAS |
| Propiedade |
Característica |
Por que? |
| Estructura |
Redes cristalinas formadas por
ións. |
Os ións de distinto signo atráense e rodéanse do maior número de
ións de signo contrario. |
| Estado
físico |
Sólidas |
O gran número de ións que forman a rede fai que se presente en estado sólido |
| Puntos de
fusión e ebulición |
Altos |
Os enlaces iónicos son enlaces fortes, difíciles de romper. |
| Dureza |
Son duras pero tamén
fráxiles |
Son duras porque os enlaces son fortes, pero son fráxiles pois ao golpealas as capas de iones desprázanse entrando en contacto
ións do mesmos signo que se repelen. |
| Solubilidade |
Son solubles en auga e disolventes
polares |
As moléculas polares como a auga rodean os
ións e sepáranos da rede se as forzas de interacción entre o ión e a auga son maiores que entre o
ión e o resto da rede. |
| Conductividade
eléctrica |
Conducen a corrente en disolución
ou fundidas |
Para que haxa conductividade debe haber movemento de cargas, os
ións só pódense mover cando están disoltos ou en estado líquido. |
|
Exemplos |
Cloruro de sodio, NaCl |
 |
|
Sulfato de cobre, CuSO4·5H2O |
 |
|
Calcita, CaCO3 |
 |
EXERCICIOS
PARA PRACTICAR

|
|
ENLACE
COVALENTE |
|
Enlace covalente: dáse entre átomos non metálicos. Caracterízase porque os átomos comparten electróns. Cando dous átomos únense mediante un enlace covalente cada átomo comparte un electrón co outro átomo para dar un par de enlace, no caso máis xeral. Os compostos covalentes forman moléculas e poden ser gases, líquidos e sólidos.
Os non metais para estabilizarse necesitan gañar electróns para conseguir configuración de gas nobre. Iso é fácil nos compostos iónicos, porque hai metais que poden perder electróns, pero que pasa cando os non metais interaccionan entre eles, pois que non poden gañar electróns porque ninguén os quere perder, así que os comparten para gañar electróns sen que ninguén os teña que perder.
Imaxínate dous átomos de flúor que se aproximan, chega un momento en que as súas nubes electrónicas solapan dando unha zona de intersección na que están os electróns que se comparten por ambos átomos. O par de electróns que se comparten é o que chamamos par de enlace covalente.
Os pares de electróns da zona de intersección son os pares de enlace, e os demais pares de electróns son os pares non enlazantes.
Estas estruturas que nos permiten entender como se comparten os electróns
nos enlaces chámanse "estruturas de Lewis".
Para debuxalas pintamos os electróns de valencia ao redor de cada átomo.
Se sabes en que grupo está un elemento sabes cantos electróns de valencia ten. Podemos darlle formas diferentes aos electróns de diferentes átomos. Con círculos rodeamos os electróns dun átomo e os que debe compartir para conseguir configuración de gas nobre. Os pares da zona de intersección son os
pares de enlace e os demais son pares non enlazantes. Tamén podemos substituír os pares de electróns con barras para visualizar
os enlaces e pares non enlazantes. Vexamos como se debuxan as estruturas de Lewis de varias moléculas sinxelas:
Molécula de Cl2
Molécula de N2
Molécula de H2O
As estruturas de Lewis non só nos permiten xustificar si unha molécula é estable ou non, tamén nos aporta máis información como a polaridad
dos enlaces e a propia estrutura da molécula a través da Teoría de Repulsión
dos Pares Electrónicos da Capa de Valencia (TRPECV) ou teoría de Gillespie.
Cando dous átomos como o Cl e o H forman un enlace, H--Cl, sempre hai un átomo que atrae os electróns do enlace máis cara a el. Dise que é máis electronegativo. No noso caso é o Cl, polo tanto a molécula de HCl será polar pois
o seu enlace é polar. Presentará unha certa carga parcial negativa sobre o cloro e unha certa carga parcial positiva sobre o hidróxeno.
O coñecer
se unha molécula é polar é importante pois condiciona as súas propiedades, o HCl disólvese ben en auga porque a auga tamén é unha molécula polar.
A electronegatividade dos átomos é unha propiedade que na táboa
periódica aumenta na diagonal que vai do cesio ao flúor, o flúor é o
elemento máis electronegativo da táboa periódica. Aínda que non saibas
exactamente que átomo é máis electronegativo nun enlace, pensa que se os
dous átomos dun enlace son distintos, un será máis electronegativo que o
outro, e xa que logo o enlace será polar.
Se os enlaces dunha molécula son polares non é condición única para que esa molécula sexa polar. Debe ter unha
xeometría adecuada para que os dipolos de enlace non se anulen por simetría. A molécula de
CO2, ten enlaces polares pero se anulan por simetría os dipolos de enlace ao ser a molécula lineal.
A seguinte simulación axudarache a entender a polaridade das moléculas:
SIMULACIÓN:
POLARIDADE DA MOLÉCULA, en phet.colorado.edu
En Dous átomos, comproba como varía a polaridade ao variar a
electronegatividade dos átomos. Podes mover a molécula e observar que sucede
ao activar un campo eléctrico.
En Tres átomos, comproba como varía a polaridade ao variar a
electronegatividade dos átomos. Podes mover a molécula e observar que sucede ao
activar un campo eléctrico. Observa que pasa cando a molécula é lineal e as
electronegatividades dos átomos dos extremos coinciden.
Como podemos coñecer a estrutura dunha molécula de varios átomos? A teoría de Lewis permítenos coñecer os pares de enlace e non enlazantes que hai sobre cada átomo dunha molécula sinxela. Estes pares se repelen dando unha estrutura na que as repulsiones minimícense.
A Teoría de Repulsión dos Pares Electrónicos da Capa de Valencia, TRPECV, ou
teoría de Gillespie, dinos que os pares enlazantes e non enlazantes ao rededor dun átomo deben estar o máis separados posible para que as repulsiones entre eles sexan mínimas.
Se sobre un átomo hai dous pares de electróns estes terán
estrutura lineal con ángulos de 180º,
se sobre un átomo hai tres pares de electróns estes terán estrutura triangular plana con ángulos de 120º,
se sobre un átomo hai catro pares de electróns estes terán estrutura tetraédrica con ángulos de 109º.
| Pares electrónicos |
Disposición dos pares |
Ángulos |
Exemplos |
| 2 |
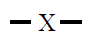
Lineal
|
180º |
BeF2
CO2
|
| 3 |
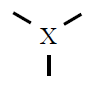
Trigonal plana
|
120º |
BF3
|
| 4 |

Tetraédica
|
109º |
CH4, NH3,
H2O |
Estas estruturas tamén che serven para saber que dipolos de enlace se
anulan por simetría.
|
ELIMÍNANSE
POR SIMETRÍA OS SEGUINTES DIPOLOS DE ENLACE |
| Dipolos de enlace iguais |
Disposición dos dipolos
de enlace |
Ángulos |
| 2 |
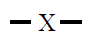
Lineal
|
180º |
| 3 |
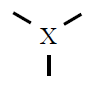
Trigonal plana
|
120º |
| 4 |

Tetraédica
|
109º |
SIMULACIÓN:
FORMA DAS MOLÉCULAS, en phet.colorado.edu
Constrúe moléculas con ata catro pares, entre enlazantes e non
enlazantes, ao redor dun átomo, e observa as estruturas que se obteñen para
que as repulsións sexan mínimas. En Moléculas reais, podes observar a
diferenza nos ángulos entre as estruturas reais e o modelo.
SIMULACIÓN:
CONTRÚE UNHA MOLÉCULA, en phet.colorado.edu
Nesta simulación, podes construír moléculas sinxelas, e en
Sala se exploración, construír posibles moléculas cos átomos que che
proporcionan. Fíxate nas estruturas 3D das moléculas.
|
PROPIEDADES DAS
SUSTANCIAS COVALENTES MOLECULARES |
| Propiedade |
Característica |
Por que? |
| Estructura |
Moléculas dun determinado número
de átomos |
Os átomos comparten electróns dando lugar a enlaces covalentes que os unen formando agregados que chamamos moléculas |
| Estado
físico |
Gas, líquido ou sólido |
As moléculas máis pequenas adoitan dar lugar a gases a non ser que as interaccións intermoleculares sexan grandes. |
| Puntos de
fusión e ebulición |
Baixos |
En xeral as forzas entre
moléculas son febles. |
| Dureza |
Brandas |
Debido ás febles forzas
intermaleculares. |
| Solubilidade |
As sustancias polares disólvense en disolventes polares, como a auga, e as sustancias apolares disólvense
en disolventes apolares. |
A solubilidade depende da polaridade das moléculas, as polares disólvense en disolventes polares e as apolares en disolventes apolares. |
| Conductividade
eléctrica |
En xeral non son condutoras |
Os electróns dos enlaces están localizados e carecen de cargas que se poidan
desprazar. |
| Exemplos |
Auga, H2O |
 |
|
Sacarosa, C12H22O11
(azúcre de mesa) |
 |
|
Xofre, S |
 |
| Outros: O2, N2,
CH4, C6H12O6,
CH3CH2OH |
|
PROPIEDADES DAS
SUSTANCIAS COVALENTES CRISTALINAS |
| Propiedade |
Característica |
Por que? |
| Estructura |
Redes cristalinas covalentes |
Os átomos comparten electróns dando lugar a estruturas cristalinas formadas por enlaces covalentes |
| Estado
físico |
Sólido |
Debido á fortaleza dos enlaces covalentes, costa moito rompelos |
| Puntos de
fusión e ebulición |
Moi altos |
A interacción entre os átomos na rede
é moi forte |
| Dureza |
Moi duras |
Son as sustancias máis duras que coñecemos debido
á fortaleza dos enlaces que as forman |
| Solubilidade |
Insolubles |
Os disolventes non son capaces de
romper os enlaces covalentes que as forman |
| Conductividade
eléctrica |
En xeral non son condutoras, anque o
grafito sí é conductor |
Os electróns dos enlaces están localizados e carecen de cargas que se poidan desprazar. Aínda que algunhas si presentan conductividade como o grafito. |
| Exemplos |
Cuarzo, SiO2 |
 |
|
Silex, rocha que contén sílice SiO2,
moi apreciada na prehistoria para a fabricación de ferramentas de
pedra. |
 |
| Outros exemplos: C(grafito), C(diamante), carborundo SiC |
SIMULACIÓN:
POLARIDAD E DIFERENCIAS DE ELECTRONEGATIVIDADE, en educaplus.org
SIMULACIÓN:
POLARIDADE DOS ENLACES, en educaplus.org
EXERCICIOS
PARA PRACTICAR

|
|
ENLACE
METÁLICO |
|
Enlace metálico: dáse entre átomos metálicos. Os átomos metálicos únense en estruturas cristalinas moi compactas nas que os electróns de valencia pódense mover con moita facilidade entre os átomos favorecendo as propiedades características dos metais como a conductividade eléctrica e térmica. Son todos sólidos coa excepción do mercurio que é líquido a temperatura ambiente.
Os metais se caracterizan por ter estruturas moi compactas e altas densidades, os seus átomos deben estar moi xuntos. Entre as súas propiedades características están a alta conductividade eléctrica e térmica. Dado que os electróns de valencia dos metais pódense perder con facilidade podemos supoñer un modelo no que os átomos distribúense en estruturas cristalinas compactas e os electróns de valencia desprázanse entre eles con facilidade, é o que se denomina o modelo da nube electrónica.
|
PROPIEDADES DAS
SUSTANCIAS METÁLICAS |
| Propiedade |
Característica |
Por que? |
| Estructura |
Redes cristalinas metálicas |
Os átomos metálicos forman
estructuras moi compactas con altos índices de coordinación |
| Estado
físico |
Sólido (o Hg é líquido) |
Os altos índices de coordinación
fan que estas estructuras sexan sólidas. |
| Puntos de
fusión e ebulición |
Medios e altos |
Hai metais que funden fácilmente
como Sn ou Pb e outros que só o fan a altísimas temperaturas
como W ou Os |
| Dureza |
Variable |
Alguns son moi brandos como o Na
que se corta con coitelo, ou o chumbo e outros presentan gran dureza
dependendo da fortaleza do enlace. En xeral son dúctiles e maleables. |
| Solubilidade |
Insolubles en auga, pero solubles noutros metais formando
aleacións, e en Hg formando amalgamas. Tamén moitos disólvense ben en ácidos. |
As moléculas de auga non os disolven pero os ácidos oxidan moitos átomos metálicos a
catións que así pasan á disolución. |
| Conductividade
eléctrica |
Son moi bos condutores |
Os electróns libres da rede
cristalina favorecen a conductividade eléctrica e térmica dos metais. |
| Exemplos |
Ouro, Au. |
 |
|
Mercurio, Hg, único metal líquido a
temperatura ambiente |
 |
|
Aluminio, Al; Ferro, Fe; Latón,
aliaxe de Cu e Zn. |
 |
EXERCICIOS
PARA PRACTICAR

|
|
ENLACES
INTERMOLECULARES |
|
Xa vimos que as sustancias covalentes moleculares podían presentarse nos tres estados: sólido, liquido e gas. Que aparezan nun ou outro depende das interaccións entre moléculas. Estas interaccións entre moléculas son un tipo de enlace que chamaremos enlaces débiles para diferencialos
dos enlaces fortes: iónico, covalente e metálico.
Estes enlaces entre moléculas poden ser de dous tipos: Forzas de Van der Waals e enlaces de hidróxeno.
As forzas de Van der Waals poden ser de varios tipos:
- Forzas de dispersión, ou forzas dipolo instantáneo - dipolo inducido.
- Forzas dipolo - dipolo inducido.
- Forzas dipolo - dipolo.
As forzas de dispersión, ou forzas dipolo instantáneo - dipolo
inducido, xustifican os puntos de ebulición máis altos do esperable para moléculas apolares como,
N2, O2, ou os gases nobres. Estas moléculas apolares non
deberan interaccionar, pero nalgunha delas pódense producir dipolos instantáneos que inducen nas que están próximas dipolos inducidos, estes dipolos formados interaccionan en breves intervalos de
tempo aumentando os puntos de ebulición.
As forzas dipolo - dipolo inducido teñen lugar ao interaccionar moléculas polares con moléculas apolares, como o
H2O (polar) co CO2 (apolar).
As forzas dipolo - dipolo son as máis intensas das tres,
as dúas moléculas deben ser polares, é o caso de interacción entre moléculas de HCl, por
exemplo.
O enlace de hidróxeno, ou enlace por pontes de hidróxeno, prodúcese en moléculas que conteñen átomos de pequeno tamaño, moi electronegativos e con pares non enlazantes, como o F,
O e N, unidos a átomos de hidróxeno, como ocorre no HF, H2O e
NH3.
A interacción entre o H e eses átomos electronegativos é moito máis forte que as interaccións dipolo-dipolo. O enlace de hidróxeno é a xustificación dos altos puntos de
ebulición do HF, H2O e NH3 fronte aos compostos de hidróxeno dos seus grupos. Observa o seguinte gráfico que nos representa os puntos de
ebulición dos compostos de hidróxeno.
SIMULACIÓN:
CARACTERÍSTICAS DOS ENLACES, en educaplus.org
EXERCICIOS
PARA PRACTICAR

|
 
|
|
