|
O modelo de Rutherford, que se coñece como modelo planetario do átomo, non explica como se moven os electróns ao redor do núcleo. Xa que logo temos a necesidade de suscitar un novo modelo que dea conta do movemento dos electróns no átomo.
Os espectroscopistas no século XIX recompilaron gran información dos que se coñece como
espectros atómicos. Os espectros atómicos obtéñense ao facer pasar un
feixe de luz a través dunha sustancia e dispersar esa luz cun prisma. Sobre o espectro de cores da luz visible aparecen unha serie de raias negras que se corresponden con diferentes frecuencias de radiación. É o que se coñece como espectros de absorción. Tamén se obteñen espectros cando se excitan os átomos dun elemento a alta temperatura para que emita luz, ao dispersar cun prisma esta luz obtemos o espectro de emisión, tamén con raias de cor características de cada sustancia, as mesmas raias que aparecen en negro
nos espectros de absorción. Os espectros de absorción ou de emisión son como a pegada dactilar dos átomos.
SIMULACIÓN: VISOR DE ESPECTROS, en educaplus.org
O primeiro científico que deu unha explicación satisfactoria dos espectros atómicos foi o físico danés
Niels Bohr. Propuxo un modelo de átomo no que os electróns móvense en orbitas en torno ao núcleo.
|
 |
|
Niels Bohr (1885-1962) |
Este modelo baséase en tres postulados:
-
Os electróns describen órbitas circulares en torno ao núcleo do átomo sen irradiar enerxía.
-
As únicas órbitas permitidas para un electrón son aquelas para as cales o momento angular, L, do electrón sexa un múltiplo enteiro do valor da constante de Plank dividida por 2π.
L=n·h/2π
-
O electrón só emite ou absorbe enerxía nos saltos dunha órbita permitida a
outra. Neste cambio emite ou absorbe un fotón cuxa enerxía é a diferenza de enerxía entre ambos
niveis.
ΔE=hν. Onde ν é a frecuencia da radiación. Cando esta frecuencia cae no espectro visible atopamos as raias dos espectros.
SIMULACIÓN:
MODELO ATÓMICO DE BOHR, en educaplus.org
Este modelo utiliza as ideas de cuantización da enerxía que propuxo
Plank a principio do XX, e chega a explicar con éxito os espectros do hidróxeno e átomos
hidroxenoides (os que só teñen un electrón). Con átomos polielectrónicos este modelo ten dificultades, que non se resolverán ata a chegada da mecánica ondulatoria da man de
Schrödinger e Heisenberg.
Segundo este modelo mecanocuántico do átomo os electróns distribúense en
orbitais, que son zonas ao redor do átomo nas que é moi probable atopar ao electrón. Estes
orbitais xorden de dous descubrimentos importantes: 1) que o electrón pódese comportar nos átomos como partícula e como onda, o que se coñece como dualidad onda-partícula, proposta polo francés
Louis-Victor de Broglie en 1924, e 2) o principio de incerteza ou indeterminación de
Heisenberg proposto en 1925, que di que non podemos coñecer con precisión a posición e a enerxía do electrón, canto máis precisión consigamos no coñecemento da posición con menos precisión coñecerase a súa enerxía.
Para coñecer a configuración electrónica, é dicir como se reparten os electróns entre os distintos orbitales, será suficiente coñecer unas poucas regras que seguirás estudando e
afondando en cursos posteriores. Estas regras dedúcense dos números cuánticos que xorden de resolver as
ecuacións de onda que a mecánica cuántica propón para explicar o comportamento dos electróns no átomo.
1. Os electróns distribúense por capas desde a de máis baixa enerxía, a 1, ás seguintes. Isto depende do
número cuántico principal, n. Pode ter os seguintes valores, n = 1, 2, 3,...
2. En cada capa hai distintos tipos de orbitales. Estes poden ser
orbitales s, orbitales p, orbitales d e orbitales f. Depende do número cuántico de momento angular, l. Pode ter os seguintes valores,
l = 0, ata n-1. Se l = 0 orbital s, se l = 1 orbital p, se l = 2 orbital d,
se l = 3 orbital f.
SIMULACIÓN:
ORBITALES ATÓMICOS, en educaplus.org
3. En cada capa hai tantos tipos de orbitais como indica o número da capa. Así na capa 1 só hai
orbitais s, na 2 orbitais s e p, na 3 orbitais s, p e d, e na 4 orbitais s, p, d e f.
4. En cada capa o orbital s é único, o p aparece en grupos de 3, o d en grupos de 5 e o f en grupos de 7. Son o que se coñece como
orbitais dexenerados ou de mesma enerxía. Depende do número cuántico magnético,
m. Pode ter os seguintes valores, m =
−l,...,0,...,+l
5. En cada orbital só caben 2 electróns como máximo. Depende do
número cuántico de spin, s. Pode ter os seguintes valores, s = +1/2, −1/2
6. En cada capa os orbitales teñen distintas enerxías, os
s son os de máis baixa enerxía, os p os seguintes en enerxía e séguenlle os
d e os f.
7. Para escribir as configuracións electrónicas dos átomos, só necesitamos saber o número de electróns que teñen e seguir
o que se coñece como a regra de enchido de orbitais.
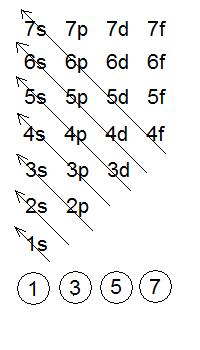
SIMULACIÓN:
CONFIGURACIÓN ELECTRÓNICA, en educaplus.org
Exemplo 5: Escribe as configuracións electrónicas
dos seguintes átomos: Li, N, Mg, Cl, Fe, Sn y Hg.
[3Li] = 1s2 2s1
Lembra que enchemos os orbitais seguindo as diagonais de abaixo a arriba, e que en cada orbital caben como máximo 2 electróns.
[7N] = 1s2 2s2 2p1
2p1 2p1
Lembra que os orbitais p sempre aparecen de tres en tres. Cando atopes
orbitais de mesma enerxía, como estes 3 orbitais p, séguese outra regra, coñecida como regra de máxima multiplicidade, e di que non se enche un orbital deste conxunto mentres haxa
orbitais baleiros.
[12Mg] = 1s2 2s2 2p2
2p2 2p2 3s2
[17Cl] = 1s2 2s2 2p2
2p2 2p2 3s2 3p2 3p2 3p1
Os orbitais dexenerados debemos escribilos separados se non están completos, se están cheos podemos agrupalos, pero lembra que
2p6
= 2p2 2p2 2p2 e non significa que haxa 6 electróns nun orbital 2p. Por iso tamén poderiamos escribir o cloro desta forma:
[17Cl] = 1s2 2s2 2p6
3s2 3p2 3p2 3p1
[26Fe] = 1s2 2s2 2p6
3s2 3p6 4s2 3d2 3d1 3d1
3d1 3d1
Lembra que os orbitais d son 5.
[50Sn] = 1s2 2s2 2p6
3s2 3p6 4s2 3d10 4p6 5s2
4d10 5p1 5p1 5p0
Tamén podemos escribir:
[50Sn] = 1s2 2s2 2p6
3s2 3p6 4s2 3d10 4p6 5s2
4d10 5p1 5p1
[80Hg] = 1s2 2s2 2p6
3s2 3p6 4s2 3d10 4p6 5s2
4d10 5p6 6s2 4f14 5d10
Chamamos electróns de valencia aos electróns da última capa electrónica. Estes electróns son moi importantes pois nos van a indicar o comportamento químico dos átomos. Fíxate que os elementos que están nun mesmo grupo da Táboa Periódica teñen o mesmo número de electróns de valencia, cando Mendeleyev colocounos en grupos é porque tiñan propiedades químicas similares, xa que logo podemos pensar que é ter os mesmos electróns de valencia o que lle confire un comportamento químico similar aos átomos dun mesmo grupo.
Como se chaman os distintos grupos da Táboa Periódica e cantos electróns de valencia teñen?
Grupo 1: Metais alcalinos (Li, Na, K, Rb, Cs) 1 e− de valencia.
Grupo 2: Metais alcalinotérreos (Be, Mg, Ca, Sr, Ba) 2 e− de
valencia.
Grupo 3 ao 12: Metais de transición.
Grupo 13: Grupo do B (B, Al, Ga, In, Tl) 3 e− de valencia.
Grupo 14: Grupo do C (C, Si, Ge, Sn, Pb) 4 e− de valencia.
Grupo 15: Grupo do N (N, P, As, Sb, Bi) 5 e− de valencia.
Grupo 16: Calcóxenos ou anfíxenos (O, S, Se, Te) 6 e− de
valencia.
Grupo 17: Halóxenos (F, Cl, Br, I) 7 e− de valencia.
Grupo 18: Gases nobres (He, Ne, Ar, Kr, Xe) 8 e− de valencia.
A maioría dos elementos da Táboa Periódica son metais, os elementos que están sobre a diagonal que vai do B ao At son
semimetais, e os elementos que están á súa dereita son non metais.
EXERCICIOS
PARA PRACTICAR

|
